
题目列表(包括答案和解析)
7.下列溶液:① 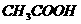 ②
② 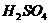 ③
③ 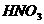 ④
④ 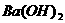 ⑤
⑤ 
⑥ ⑦
⑦  ⑧
⑧ 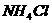 其物质的量浓度均为
其物质的量浓度均为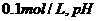 由小到大排列顺序为 ( )
由小到大排列顺序为 ( )
A.③②①⑥⑦⑧④⑤ B.④⑤⑥⑦⑧①③②
C.②③①⑧⑦⑥⑤④ D.②③①⑥⑦⑧⑤④
6.下面是合成氨的简要流程示意图:
|
|
 N2 (1体积)
N2 (1体积)
|


 H2 (3体积)
H2 (3体积)

沿x路线回去的物质是 ( )
A.N2和H2 B.催化剂 C.N2 D.H2
5.右图曲线a表示放热反应 X(g)+Y(g) Z(g)+M(g)+N(s) 进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
Z(g)+M(g)+N(s) 进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
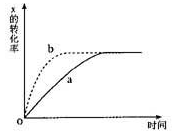 A.升高温度
A.升高温度
B.加大X的投入量
C.缩小容器的容积
D.增大容器的体积
4.在恒容的各个密闭容器中,下列反应分别达到平衡后,有关说法正确的是 ( )
A.2HI(g)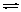 H2(g)+I2(g);△H>0,若降低温度,颜色加深,压强增大
H2(g)+I2(g);△H>0,若降低温度,颜色加深,压强增大
B.2NO2(g)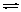 N2O4(g);△H<0,充入氩气,压强增大,红棕色变浅
N2O4(g);△H<0,充入氩气,压强增大,红棕色变浅
C.2SO2(g)+O2(g)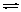 2SO3(g);△H<0,升温后,气体密度不变,平均相对分子
2SO3(g);△H<0,升温后,气体密度不变,平均相对分子
质量减小
D.3Fe(s)+4H2O(g)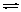 Fe3O4(s)+4H2(g);△H<0,加入铁后,Fe3O4将增加
Fe3O4(s)+4H2(g);△H<0,加入铁后,Fe3O4将增加
3.3.2gCu与过量的8mol/L30mLHNO3反应,硝酸的还原产物为NO2和NO,反应结束后测得溶液中n(H+)为amol,则溶液中所含n(NO3-)为 ( )
A.amol B.(0.1+a)mol C.(0.05+a)mol D.(0.2+a)mol
2. 反应 4NH3+5O2 4NO+6H2O在550℃的5L密闭容器中进行,0.5min后,NO的物质的量增加了0.3mol,则此反应的平均速率可表示为 ( )
反应 4NH3+5O2 4NO+6H2O在550℃的5L密闭容器中进行,0.5min后,NO的物质的量增加了0.3mol,则此反应的平均速率可表示为 ( )
A.V(O2)=0.01mol.L-1.s B.V(NO)=0.008mol.L-1.s-1
C.V(H2O)=0.006mol.L-1.s-1 D.V(NH3)=0.002mol.L-1.s-1
1.氮气能大量存在于空气中,且能维持含量基本稳定的主要原因是 ( )
A.氮分子结构稳定 B.氮元素不活泼
C.氮分子是非极性分子 D.氮分子中存在非极性键
2.(7分)向8 g某二价金属的氧化物固体中加入稀硫酸,使其恰好完全溶解,已知所消耗稀硫酸的体积为100 mL,在所得溶液中插入铂电极进行电解,通电一定时间后,在一个电极上收集到224 mL(标准状况)氧气,在另一个电极上析出该金属1.28g。
(1)根据计算确定金属氧化物的名称。
(2)计算通电后剩余的混合溶液中,硫酸的物质的量浓度(溶液体积按100mL计算)。
1.(6分)测定NaOH和Na2CO3的混合液中NaOH的含量时,可先在混合液中加入过量的BaCl2溶液,使Na2CO3完全变成BaCO3沉淀,然后用已知浓度的盐酸滴定(用酚酞作指示剂,其变色pH范围为8~10)。试回答:
(1)滴定时BaCO3能否溶解? (填“能”或“不能”),理由是
;
(2)如用甲基橙作指示剂(其变色pH范围为3.1~4.4),则测定的结果 (填“偏高”、“偏低”或“无影响”)。原因是 。
3.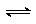 (7分)在容积为1L的密闭容器中,充入1 mol N2和4 mol H2,一定条件下反应N2+3H2 2NH3 达到平衡,此时N2和H2的物质的量之比恰好为 1:5。试回答下列问题:
(7分)在容积为1L的密闭容器中,充入1 mol N2和4 mol H2,一定条件下反应N2+3H2 2NH3 达到平衡,此时N2和H2的物质的量之比恰好为 1:5。试回答下列问题:
(1)平衡时混合气体的压强与起始时混合气体的压强相比 (填“偏高”、“偏低”或“相等”)。
(2)该平衡混合气中NH3的体积分数是 。
(3)平衡时,H2的转化率为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com