
题目列表(包括答案和解析)
30.(7分)某溶液含有Na+、Al3+、Fe2+、Cl-、NO-3、HCO-3、I- 等离子中的若干种。依次进行下列实验,现象如下:
① 用pH试纸检验,溶液的pH<7;
② 取少量溶液滴加氯水,再加入CCl4振荡、静置,下层显紫红色,而后分液;
③ 向实验②分液后所得的水溶液中加入AgNO3与HNO3的混合溶液,有白色沉淀产生;
④ 另取少量原溶液加入过量NaOH溶液,产生白色沉淀并迅速变为灰绿色,最后变为红褐色,然后过滤;
⑤ 向实验④所得滤液中通入过量CO2气体,有白色沉淀产生。
请回答下列问题:
(1)原溶液中肯定存在的离子有_____________,肯定不存在的阴离子有____________。
(2)实验④中白色沉淀变为红褐色的化学反应方程式为___________________________。
(3)实验⑤中产生白色沉淀的离子方程式是_____________________________________。
29.(9分)无机物A-J能发生下图所示的转化,其中A、B、C、D、G含有同一种元素,H是目前世界上用量最大的金属,E是气态单质,F可作磁性材料,J为红棕色固体。

根据图示回答问题:
(1)写出下列物质的化学式:B________、G________、H________。
(2)反应③叫做________反应,该反应原理可用在生产上,如 。
(3)反应④的化学方程式为________________________________。
(4)写出下列反应的离子方程式:①_____________________,②__________________。
(5)在实验室把B完全转化为D,最好在B溶液中加入过量的___________。
28.(3分)航天技术使用的氢氧燃料电池具有高能、轻便、无污染等优点。氢氧燃料电池有酸式和碱式两种,酸式氢氧燃料电池中的电解质是酸,其负极的电极反应式为__________;碱式氢氧燃料电池中的电解质是碱,写出其电极反应式:负极__________________________;正极__________________________。
26.(4分)配平下列氧化还原反应方程式并回答问题:
Fe3O4+ HNO3 === Fe(NO3)3+ NO↑+ H2O
当溶解23.2 g Fe3O4时,转移电子________mol。
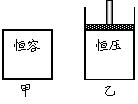 27.(6分)如右图,在一定温度下,向容积均为5 L的甲、乙两容器中分别充入0.5 mol N2O4气体,发生反应 N2O4
27.(6分)如右图,在一定温度下,向容积均为5 L的甲、乙两容器中分别充入0.5 mol N2O4气体,发生反应 N2O4 2NO2 。当反应进行到2 s时,测得甲容器中N2O4的浓度为0.08 mol/L。经过60 s时甲容器中的反应达到平衡。
2NO2 。当反应进行到2 s时,测得甲容器中N2O4的浓度为0.08 mol/L。经过60 s时甲容器中的反应达到平衡。
(反应过程中两个容器的温度均保持恒定)
(1)前2 s内,甲容器中以N2O4的浓度变化表示的平均反应速率为
。
(2)达到平衡时,乙容器中反应所需的时间 60 s(填“>”、“<”或“=”);两容器中的反应都达到平衡时, 容器中N2O4的转化率较大。
2. 答卷前将答题卷密封线内的项目填写清楚。
1. 用钢笔或圆珠笔(蓝或黑色)将答案写在答题卷上。
25. 在含a mol Fe2(SO4)3和b mol CuSO4的混合溶液中,加入c mol Fe,充分反应后,经测定溶液中含有Fe2+ 和Cu2+,同时还有固体物质,则a、b、c的关系一定正确的是
A. a<c<(a+b) B. b<c<(a+b) C. (a+c)<b D. (a+b)<c
第Ⅱ卷(非选择题,共50分)
注意事项:
24. 在一定温度下,某容器内气体X、Y的物质的量随反应时间变化的曲线如右图所示。下列判断错误的是
A. t1时,c(Y)=2c(X)
B. 反应的化学方程式为 2Y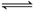 X
X
C. t2时,v(正)=v(逆),反应达到平衡状态
D. t3时,混合气体中X的体积分数为71.4 %
23. 下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是
A.AlCl3和NaOH B.NaHSO4和Ba(OH)2
 C.Na2CO3和HCl D.NaAlO2和H2SO4
C.Na2CO3和HCl D.NaAlO2和H2SO4
22. 常温下将稀NaOH溶液与CH3COOH溶液混合,不可能出现的结果是
A.pH<7且c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.pH>7且c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C.pH>7且c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
D.pH=7且c(Na+)>c(CH3COO-)>c(H+)=c(OH-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com