
题目列表(包括答案和解析)
7.可逆反应N2+3H2 2NH3的正逆反应速率可用各反应物或生成物浓度的变化来表示。下列关系中能说明反应已达到平衡状态的是
2NH3的正逆反应速率可用各反应物或生成物浓度的变化来表示。下列关系中能说明反应已达到平衡状态的是
A.3v正(N2)= v正(H2) B.v正(N2)= v正(NH3)
C.2v正(H2)=3 v正(NH3) D.v正(N2)=3 v逆(H2)
6.将pH=5的盐酸溶液稀释1000倍后,溶液的pH为
A.等于8 B.等于7 C.略小于7 D.略大于7
5.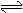 在新制的氯水中存在平衡:Cl2+H2O HCl+HClO。加入少量下列物质能使c(HClO)增大的是
在新制的氯水中存在平衡:Cl2+H2O HCl+HClO。加入少量下列物质能使c(HClO)增大的是
A.CaSO3 B.NaOH C.CaCO3 D.HCl
4. 反应:A(气)+3B(气) 2C(气) ∆H<0 达平衡后,将气体混和物的温度降低,下列叙述中确
反应:A(气)+3B(气) 2C(气) ∆H<0 达平衡后,将气体混和物的温度降低,下列叙述中确
的是
A、正反应速率加大,逆反应速率变小,平衡向正反应方向移动
B、正反应速率变小,逆反应速率加大,平衡向逆反应方向移动 .
C、正反应速率和逆反应速率都变小,平衡向正反应方向移动
D、正反应速率和逆反应速率都变小,平衡向逆反应方向移动
3.在一定条件下,发生CO(g)+NO2(g) CO2(g)+NO(g)(正反应为放热反应)的反应,达到平衡后,保持体积不变,降低温度,混合气体的颜色
CO2(g)+NO(g)(正反应为放热反应)的反应,达到平衡后,保持体积不变,降低温度,混合气体的颜色
A.变深 B.变浅 C.不变 D.无法判断
2.下列各组物质全部是弱电解质的是
A.H2O、NH3·H2O、H3PO4、HF B.Cu(OH)2、 CH3COOH、C2H5OH、CH3COONa
C.H2SO3、Ba(OH)2、BaSO4 D.H2SiO3、H2S、CO2
1. 1g氢气在氧气中燃烧生成液态水,放出142.9kJ的热量,表示该反应的热化学方程式是
A. H2 +1/2 O2 == H2O ∆H= -285.8kJ/mol
B.2H2(g)+O2(g)==2H2O(l) ∆H= -285.8kJ/mol
C.H2(g)+1/2 O2(g)==H2O(l) ∆H= -285.8kJ/mol
D.H2(g)+1/2 O2(g)== H2O(g) ∆H= -285.8kJ/mol
33.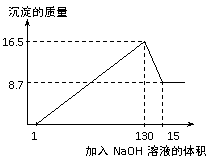 (9分)将一定量的铝镁合金投入到一定浓度的100 mL盐酸中,合金全部溶解。向所得溶液中滴加5 mol/L NaOH溶液至过量,生成沉淀的质量与加入NaOH溶液的体积关系如下图所示。试计算:
(9分)将一定量的铝镁合金投入到一定浓度的100 mL盐酸中,合金全部溶解。向所得溶液中滴加5 mol/L NaOH溶液至过量,生成沉淀的质量与加入NaOH溶液的体积关系如下图所示。试计算:
(1)原合金中Al、Mg的质量。
32.(4分) 5.76 g Cu与150 mL 2.0 mol/L稀硝酸充分反应。假设反应后的溶液仍为150 mL,求溶液中NO-3 的物质的量浓度(必须写出计算过程)。
31.(8分)某光卤石(KCl·MgCl2·6H2O)样品中含有不与盐酸和NaOH溶液反应的杂质。要测定其中镁元素的质量分数,可进行如下实验:
① 准确称取1.280 g样品,放入锥形瓶中加入适量的水溶解;
② 用滴定管向锥形瓶中加入0.5000 mol/L的NaOH溶液20.00 mL,振荡;
③ 向步骤②的锥形瓶中加入指示剂2-3滴;
④ 用0.1000 mol/L的盐酸滴定过量的NaOH至终点,消耗盐酸20.00 mL。
已知指示剂变色的pH范围分别是:石蕊5.0-8.0,酚酞8.2-10.0,甲基橙3.1-4.4。
回答下列问题:
(1)实验步骤②中发生反应的离子方程式是 。
(2)所有实验操作中,需要用待盛装的溶液润洗的仪器是_________________。
(3)为使测定结果误差小,应选用的指示剂是_________,理由是______________。
(4)如果在步骤④中滴加盐酸过量,则会使测定结果_______。(填“偏低”、“偏高”、“不受影响”)
(5)光卤石样品中镁元素的质量分数是_____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com