
题目列表(包括答案和解析)
4.葡萄糖所含的全部元素是( )
A.C、H、O B.C、0 C.H、O D.C、H、N
3.现代生活中出现了“铁强化酱油”、“高钙牛奶”、“富硒茶叶”、“含氟牙膏”等商品。这里的铁、钙、硒、氟应理解为( )
A.元素 B.单质 C.分子 D.氧化物
2.“垃圾是放错了地方的资源”,应分类回收利用。生活中废弃的塑料袋、废纸、橡胶制品等属于( )
A.无机物 B.有机物 C.盐类 D.糖类
1.当前科学家认为温室效应将导致地球表面温度缓慢升高,为保护人类赖以生存的环境,必须予以密切关注,造成温室效应的原因是人类向空气大量排放了( )
A.CO B.C02 C.S02 D.NO
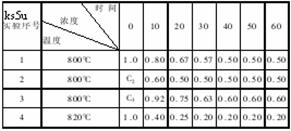
24.(6分)在溶液中进行某化学反应 2A  B + D 在四种不同条件下进行,B、D 起始浓度为零,反应物 A 的浓度(mol/L)随反应时间(min)的变化情况如下表 :
B + D 在四种不同条件下进行,B、D 起始浓度为零,反应物 A 的浓度(mol/L)随反应时间(min)的变化情况如下表 :
根据上述数据,完成下列填空:
(1)在实验 1,反应在 10至 20分钟时间内平均速率(VA)为 mol/(L·min)。
(2)在实验 2,A 的初始浓度 C2= mol/L,反应经 20分钟就达到平衡,可推测实验 2中还隐含的条件是 。
(3)设实验 3的反应速率为 v3,实验 1的反应速率为 v1,则 v3 v1(填“ > ”、“ = ”、“ < ”),且 C3 1.0mol/L(填“ > ”、“ = ”、“ < ”)
(4)比较实验 4和实验 1,可推测该反应是 反应(选填吸热、放热)。
23.(6分) 在火箭推进器中装有还原剂肼(N2H4)和强氧化剂H2O2,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热量。已知0.4mol液态肼和足量双氧水反应生成氮气和水蒸气时放出256.65KJ的热量。
(1)写出肼和过氧化氢的结构式 肼______ ___,
过氧化氢______ ____。
(2)上述反应应用于火箭推进剂,除释放出大量热量和快速产生大量气体外,还有一个很突出的优点是_____________________ _________。
(3)写出肼和双氧水反应的热化学方程式_____________________________。
(4)已知H2O(l)==H2O(g);△H=+44KJ/mol,则16g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是_________________。
(5)已知N2(g) + 2O2(g) == 2NO2(g);△H=+67.7KJ/mol,
N2H4(g) + O2(g) == N2(g)+2H2O(g);△H= -534KJ/mol,
则肼与NO2完全反应的热化学方程式为_______________________________。
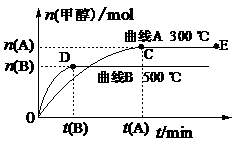
22.(4分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g),反应过程如下图所示:
CH3OH(g),反应过程如下图所示:
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在500 ℃,从反应开始到平衡,氢气的平均反应速率v (H2)=
[用n(B)、t(B) 表示]。
(3)在其他条件不变的情况下,对处于E点的体系将体积压缩到原来的1/2,下列有关该体系的说法正确的是
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
21.(12分)(1)对于下列反应:2SO2
+ O2  2SO3 ,
如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_______
______。
2SO3 ,
如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_______
______。
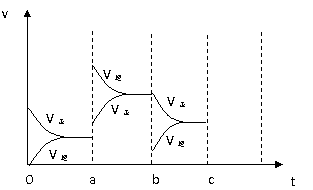
(2)下图左表示在密闭容器中反应:2SO2+O2 2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是 ;b c过程中改变的条件可能是
.
2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是 ;b c过程中改变的条件可能是
.
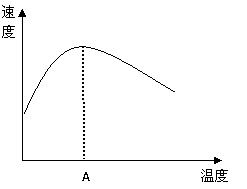 (3)酶是蛋白质,具有蛋白质的特性,酶能催化很多化学反应,下图表示酶参加的反应中,温度与反应速率的关系。
(3)酶是蛋白质,具有蛋白质的特性,酶能催化很多化学反应,下图表示酶参加的反应中,温度与反应速率的关系。
解释曲线变化原因
。
20.(8分)1840年盖斯指出:若是一个反应可以分几步进行,则各步反应的反应热总和与这个反应一次发生时的反应热相同。请回答:
⑴ 已知热化学方程式:C(S,金刚石)+ O2(g)= CO2(g) △H = -395.41KJ/mol
C(S,石墨)+ O2(g)= CO2(g) △H = -393.51KJ/mol
则金刚石转化为石墨的热化学方程式为____________________,由热化学方程式看来更稳定的碳的同素异形体是____________________
⑵ 燃烧3.1g白磷比燃烧3.1g红磷放出的热量多1.839KJ,则白磷转化为红磷的热化学方程式是____________________________,相同温度下,能量状态最低的是__________。
19.(10分)氯化氢和氧气在一定条件下反应可得到氯气,现将氯化氢和氧气混合于一密闭容器中,在温度120℃、压强1.01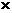 105P条件下使之反应,,经过5min后,测定物质的浓度分别为:c(HCl) =
0.25mol/L,c(O2) =
0.2mol/L,c(Cl2) =
0.1mol/L。则:
105P条件下使之反应,,经过5min后,测定物质的浓度分别为:c(HCl) =
0.25mol/L,c(O2) =
0.2mol/L,c(Cl2) =
0.1mol/L。则:
(1)反应的化学方程式为 ____________________________________________;
(2)开始时c(HCl) = _________________,c(O2) = ____________________;
(3)从开始反应到5min后,这段时间,v(HCl) = _________________,以HCl、O2、Cl2分别表示的反应速率的数值之比为______________;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com