
题目列表(包括答案和解析)
19.(13分)
(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是_________________。
A.C(s)+H20(g)=C0(g)十H2(g) △H>O
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H20(l) △H<O
C.2H2(g)+O2(g)=2H2O(l) △H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应为:____________________________________________________________。
(3)电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与右图中电解池相连,其中,a为电解液,X和Y是两块电极板,则:
①若X和Y均为惰性电极,a为CuSO4溶液,则电解时的化学反应方程式为______________________________。通过一段时间后,向所得溶液中加入0.2molCu0粉末,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为__________________。
②若X、Y分别为铁和铜,a仍为CuSO4溶液,则Y极的电极反应式为_________________________________________。
18.(9分)士兵在野外加热食物时通常采用“无焰食物加热器”,其主要化学成分为镁粉、铁粉、氯化钠,使用时加入水与其中的镁反应放出热量。下面是在相同的室温下对该产品的两个探究实验:
[实验1]向加有等量水的隔热容器中分别加入下列各组物质,结果参见下图1。
①1.0mol镁条、0.10mol铁粉、0.10mol氯化钠粉末;
②将1.0mol镁条剪成100份、0.10mol铁粉、0.10mol氯化钠粉末;
③1.Omol镁粉、0.10mol铁粉、0.10mol氯化钠粉末;
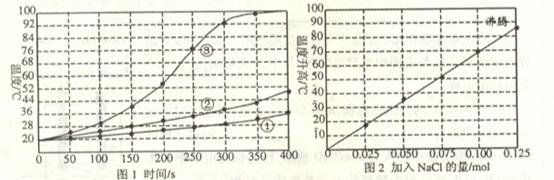
[实验2]向加有lOOmL水的隔热容器中分别加入0.10mol镁粉、0.50mol铁粉及不同量的氯化钠粉末,不断搅拌,第15min时记录温度升高的幅度参见上图2。
请回答下列问题:
(1)实验1证实影响镁与水反应速率的主要因素是_____________________。
A.反应温度 B.NaCl的用量 C.铁的用量 D.镁的表面积
(2)实验2中当NaCl的用量大于0.125mol时,实验就无须再做的原因是____________。
A.加入更多的NaCl不再增加反应速率
B.加入NaCl反而会降低反应速率
C.已达到沸点不再有温度变化
D.需要加入更多的铁粉来提高温度
(3)如果在实验2中加入了0.060molNaCl,则第15min时混合物升高的温度最接近于____________。
A.34℃ B.42℃ C.50℃ D.62℃
(4)铁粉、NaCl能使反应速率增加的原因是___________________________________。
17.(10分)为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式_________________________________________。
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
|
化学键 |
H-H |
N-H |
N≡N |
|
键能/kJ·mol-1 |
436 |
391 |
945 |

 已知反应N2+3H2 NH3 △H=a kJ·mol-1。试根据表中所列键能数据估算a的数值为___________________。
已知反应N2+3H2 NH3 △H=a kJ·mol-1。试根据表中所列键能数据估算a的数值为___________________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+02(g)=C02(g) △H1=-393.5kJ·mol-1
2H2(g)+02(g)=2H20(l) △H2=-571.6kJ·mol-1
2C2H2(g)+502(g)=4C02(g)+2H20(l) △H3=-2599kJ·mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变:
△H=______________________________________。
16.如图是恒温下某化学反应的反应速率随反应时间变化的示意图,下列叙述与示意图不相符合的是( )
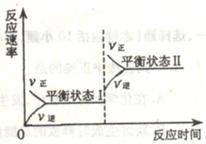 A.反应达平衡时,正反应速率和逆反应速率相等
A.反应达平衡时,正反应速率和逆反应速率相等

 B.若反应为A(g)+B(g) C(s),则平衡移动的原因是增大压强
B.若反应为A(g)+B(g) C(s),则平衡移动的原因是增大压强
C.由图像关系可以判断,正反应为吸热反应
D.平衡状态Ⅰ和平衡状态Ⅱ的平衡常数的大小关系为K1=K2
2008-2009学年度第一学期学段检测
高二化学试题
Ⅰ卷答案栏
第Ⅱ卷(非选择题,共56分)
15.
 某温度下,已知反应mX(g)+nY(g) qZ(g)△H>O,m+n>q,在体积一定的密闭容器中达到平衡,下列叙述正确的是( )
某温度下,已知反应mX(g)+nY(g) qZ(g)△H>O,m+n>q,在体积一定的密闭容器中达到平衡,下列叙述正确的是( )
A.反应速率v正(X)=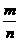 v逆(Y) B.加入X,反应的△H增大
v逆(Y) B.加入X,反应的△H增大
C.增加Y的物质的量,X的转化率增大 D.降低温度,平衡向正反应方向移动
14.某电解池内盛有某电解质溶液,插入两根电极,通电后欲达到下列要求:①阳极质量不变②阴极质量增加③电解液pH变小。则可选用的电极材料和电解质溶液是( )
A.铂做阳极、铜做阴极,电解硫酸铜溶液
B.石墨做阳极和阴极,电解硫酸
C.铜做阳极、铁做阴极,电解氯化铜溶液
D.铜做阳极、铜做阴极,电解硫酸铜溶液
13.下列说法正确的是( )
A.氢镍碱性电池原理为H2+2NiO(OH)==2Ni(OH)2,则该电池负极反应式为:
H2-2e-+20H-==2H20
B.热化学方程式中的计量系数既可以表示物质的量,也可以表示分子个数。
C.已知1g氢气燃烧生成水蒸气放出120. 9kJ的热,水蒸气分解的热化学方程式为:2H20(g)==2H2(g)+02(g);△H=-483.6kJ·mol。
D.已知S(s)+02(g)=S02(g);△H1
S(g)+02(g)==SO2(g);△H2,则△H1<△H2
12.
 常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两实验:(N204 2NO2△H>O)(a)将两容器置于沸水中加热;(b)在活塞上都加2kg的砝码。在以上两情况下,甲和乙容器的体积大小的比较,正确的是( )
常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两实验:(N204 2NO2△H>O)(a)将两容器置于沸水中加热;(b)在活塞上都加2kg的砝码。在以上两情况下,甲和乙容器的体积大小的比较,正确的是( )
A.(a)甲>乙,(b)甲>乙
B.(a)甲>乙,(b)甲=乙
C.(a)甲<乙,(b)甲>乙
D.(a)甲>乙,(b)甲<乙
11.已知:C(s,金刚石)=C(s,石墨) △H=-1.9 kJ·mol。
C(s,金刚石)+02(g)=CO2(g) △H1
C(s,石墨)+02(g)=CO2(g) △H2
根据已述反应所得出的结论正确的是( )
A.△H1=△H2 B.△H1<△H2
C.△H1>△H2 D.石墨比金刚石稳定
10.
 在密闭容器中进行如下反应:X2(g)+Y2(g) 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol·L-1、0.3mol·L-1、0.2mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
在密闭容器中进行如下反应:X2(g)+Y2(g) 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol·L-1、0.3mol·L-1、0.2mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
A.Y2为0.2mol·L-1 B.Y2为0.35mol·L-1
C.X2为0.2mol·L-1 D.Z为0.4mol·L-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com