
题目列表(包括答案和解析)
14.莫尔盐[(NH4)2Fe(SO4)2·6H2O]常作氧化还原滴定法的基准物质,在0.1mol/L 的该盐的溶液中,下列有关比较不正确的是
A.c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-)
B.c(NH3·H2O)+c(NH4+)=0.2 mol/L
C.2c(SO42-)+c(OH-)=c(NH4+)+2c(Fe2+)+c(H+)
D.c(H+)=c(OH-)+c(NH3·H2O)
13.以NA代表阿伏加德罗常数,则关于热化学方程式
C2H2 ( g ) +5/2O2 ( g ) →2CO2 ( g )+H2O ( l ) △H = -1300kJ / mol 的说法中,正确的是
 A.当10 NA个电子转移时,该反应吸收1300kJ的能量
A.当10 NA个电子转移时,该反应吸收1300kJ的能量
B.当1 NA个水分子生成且为液体时,吸收1300kJ的能量
C.当2 NA个碳氧共用电子对生成时,放出1300kJ的能量
D.当8 NA个碳氧共用电子对生成时,放出1300kJ的能量
12.常温下,下列各组数据中比值为2:1的是
A.Na2CO3溶液中c(Na+)与c(CO32-)之比
B.0.2 mol·L-1 的CH3COOH溶液与0.1 mol·L-1的盐酸中c(H+)之比
C.pH=7的氨水与(NH4)2SO4的混合溶液中,c(NH4+)与c(SO42-)之比
D.pH=12 的Ba(OH)2溶液与pH=12 的KOH溶液中溶质的物质的量浓度之比
11.在外界提供相同电量的条件,Cu2+或Ag+分别按Cu2++2e-→Cu Ag++e-
→Ag在电极上放电,若析出铜的质量为1.92g,则析出银的质量为
A.1.62g B.6.48g C.3.24g D.12.96g
10.PH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>a,则该电解质可能是 
A.NaOH B.H2SO4 C.AgNO3 D.Na2SO4
9. 在密闭容中发生下列反应aA(g)
在密闭容中发生下列反应aA(g) cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A.A的转化率变小
B.平衡向正反应方向移动
C.D的体积分数变大
D.a > c+d
8.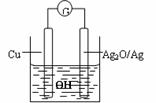 普通水泥在固化过程中自由水分子减少并产生Ca(OH)2,溶液呈碱性。根据这一物理化学特点,科学家发明了电动势法测水泥初凝时间。此法的原理如图所示,反应的总方程式为:2Cu + Ag2O ==Cu2O + 2 Ag,下列有关说法正确的是
普通水泥在固化过程中自由水分子减少并产生Ca(OH)2,溶液呈碱性。根据这一物理化学特点,科学家发明了电动势法测水泥初凝时间。此法的原理如图所示,反应的总方程式为:2Cu + Ag2O ==Cu2O + 2 Ag,下列有关说法正确的是
A.装置中电流方向由Cu经导线到Ag2O
 B.测量原理示意图中,Ag2O为负极
B.测量原理示意图中,Ag2O为负极
C.负极的电极反应式为:
2Cu + 2OH- -2e-==Cu2O + H2O
D.电池工作时,OH-向正极移动
7.一些盐的结晶水合物,在温度不太高时就有熔化现象,即溶于自身的结晶水中,又同时吸收热量。他们在塑料袋中经日晒就熔化,又在日落后缓慢凝结而释放热量。故可用于调节室内温度,或用作夏日防暑的枕垫或坐垫,这些物质可称之为热材料。现有几种盐的结晶水合物,有关数据如下:
|
|
① Na2S2O3·5H2O |
②CaCl2·6H2O |
③Na2SO4·10H2O |
④ Na2HPO4·10H2O |
|
熔点/℃ |
40-50 |
29.92 |
32.38 |
35.1 |
|
熔化热/kJ· mol-1 |
49.7 |
37.3 |
77 |
100.1 |
根据上述数据和实用性考虑,实际运用时常采用的物质应该是
A.① B.② C.③ D.④
6.下列说法正确的是
A.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
5.下列叙述的方法不正确的是
A.金属的电化学腐蚀比化学腐蚀更普遍 B.用铝质铆钉铆接铁板,铁板易被腐蚀
C.钢铁在干燥空气中不易被腐蚀 D.用牺牲锌块的方法来保护船身
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com