
题目列表(包括答案和解析)
2. 瑞士化学家盖斯,根据一系列事实于1840年提出:不管化学反应是一步或分数步完成,这一过程的热效应相同。换言之,若一个反应可分成几步反应完成,则各步反应的反应热总和与该反应一次发生时反应热相同。应用这个原理,已知:C(s)+O2(g)=CO2(g) ∆H= -393.5kJ/mol;CO(g)+1/2 O2(g)=CO2(g) ∆H= -283kJ/mol;则C(s)与O2(g)反应生成1molCO(g)的反应热为 ( )
A. ∆H= -676.5kJ/mol B. ∆H= +676.5kJ/mol
C. ∆H= -110.5kJ/mol D.∆H= +110.5kJ/mol
1.在北京奥运会期间,氢燃料电池公交汽车已经驶上北京街头,体现“科技奥运,绿色奥运”。下列说法正确的( )
A.电解水制取氢气是理想而经济的制氢方法
B.发展氢燃料电池汽车不需要安全高效的储氢技术
C.氢燃料电池把氢气和氧气燃烧放出的热能转化为电能
D.氢燃料电池汽车的使用可以有效减少城市空气污染
23.(17分)实验室常利用甲醛(HCHO)法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO=3H++6H2O+(CH2)6N4H+ (滴定时,1 mol (CH2)6N4H+与l mol H+相当),然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
步骤I称取样品1.500 g。
步骤II将样品溶解后,完全转移到250 mL 容量瓶中,定容,充分摇匀。
步骤Ⅲ移取25.00 mL 样品溶液于250 mL 锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min 后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数 (填“偏高”、“偏低”或“无影响”)
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积
(填“偏大”、“偏小”或“无影响”)
③滴定时边滴边摇动锥形瓶,眼睛应观察
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由 色变成 色
(2)滴定结果如下表所示:
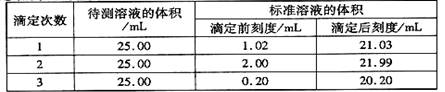
若NaOH标准溶液的浓度为0.1010 mol·L-1 ,计算该样品中氮的质量分数。(写出计算过程)
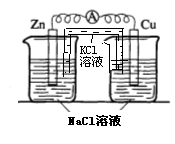
22.(17分)某校化学兴趣小组为了探究原电池工作原理,进行如下系列实验:
实验一 实验二
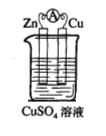
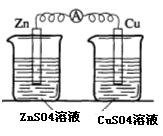
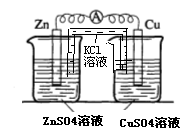
实验三 实验四
结果:
 (1)实验一中铜片、锌片表面均有红色物质析出,电流计指针偏转,但较短时间内电流即明显减小。实验结束时测得锌片减少了3.94g,铜片增重了3.84g,则该原电池的工作效率是(指参加原电池反应的锌占反应总量的百分率):
。
(1)实验一中铜片、锌片表面均有红色物质析出,电流计指针偏转,但较短时间内电流即明显减小。实验结束时测得锌片减少了3.94g,铜片增重了3.84g,则该原电池的工作效率是(指参加原电池反应的锌占反应总量的百分率):
。
(2)实验二中刚将铜、锌片插入溶液中时电流计指针有偏转,但立即就归零了。为什么锌的电子不能持续通过导线流向铜极给Cu2+? 。
(3)实验三中盐桥中K+流向 溶液(填ZnSO4或CuSO4),如果Zn的消耗速率为1×10-3mol/s,则K+的迁移速率为 mol/s。
(4)实验四中电流计指针有偏转,写出铜极的电极反应式:

21.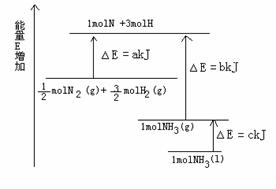 (10分)已知化学反应N2+3H2=2NH3的能量变化如图所示,
(10分)已知化学反应N2+3H2=2NH3的能量变化如图所示,
(1)1mol N 和3mol H 生成1mol NH3(g)是 能量的过程(填“吸收”或“释放”)。
(2)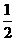 N2(g)+
N2(g)+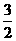 H2(g)=NH3(g)
△H =
H2(g)=NH3(g)
△H =
(3)N2(g)和H2(g)生成NH3(1)的热化学方程式 。
20.(4分)从NO3-、SO42-、H+、Cu2+、Ba2+、Ag+、Cl-等离子中选出适当的离子组成电解质,采用惰性电极对其溶液进行电解。若两极分别放出气体,且体积比为1:1,电解质的化学式可能是 。
19.(9分)某温度下SO2的转化反应(2SO2+O2  2SO3)的平衡常数K =576 下面三个混合体系中各物质的浓度如下表:
2SO3)的平衡常数K =576 下面三个混合体系中各物质的浓度如下表:
|
体系 |
c(SO2) mol/L |
c(O2) mol/L |
c(SO3) mol/L |
反应方向 |
|
(1) |
0.0600 |
0.400 |
2.00 |
|
|
(2) |
0.0960 |
0.300 |
0.500 |
|
|
(3) |
0.300 |
0.0400 |
1.44 |
|
试判断各体系中反应进行的方向:
体系(1)
体系(2)
体系(3) 。
17.下图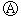 为直流电源,
为直流电源,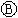 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸,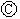 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现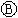 上的c点显红色.为实现铁上镀锌,接
上的c点显红色.为实现铁上镀锌,接 通
通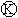 后,使c、d两点短路.下列叙述正确的是
后,使c、d两点短路.下列叙述正确的是
A.a为直流电源的负极
B.c极发生的反应为2H++2e-=H2↑
C.f电极为锌板
D.e极发生还原反应


|
 2NO2 △H > 0)
2NO2 △H > 0)
|
(a)将两容器置于沸水中加热
(b)在活塞上都加2 kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是
A.(a)甲>乙,(b)甲>乙 B.(a)甲>乙,(b)甲=乙
C.(a)甲<乙,(b)甲>乙 D.(a)甲>乙,(b)甲<乙
第Ⅱ卷(非选择题,共57分)
16.在15 mL 0.1 mol·L-1 KOH溶液中逐滴加入0.2 mol·L-1甲酸溶液,溶液pH和加入的甲酸的体积关系曲线如下图所示,有关粒子浓度大小关系正确的是 
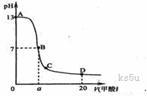

A.在A、B间任意一点:c(K+)>c(HCOO-)>c(OH-)>c(H+)
B.在B点:c(K+)=c(HCOO-)>c(OH-)=c(H+),且a=7.5
C.在C点:c(HCOO-)>c(K+)>c(OH-)>c(H+)
D.在D点:c(HCOO-)+c(HCOOH)>2c(K+)
15.反应PCl5(g)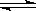 PCl 3(g)+Cl2(g) ①
PCl 3(g)+Cl2(g) ①
2HI(g)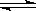 H2(g)+I2(g)
②
H2(g)+I2(g)
②
2NO2(g)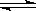 N2O4(g)
③
N2O4(g)
③
在一定条件下,达到化学平衡时,反应物的转化率均是a%。若保持各自的温度不变、体积不变,分别再加入一定量的各自的反应物,则转化率


A.均不变
B.均增大
C.①增大,②不变,③减少
D.①减少,②不变,③增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com