
题目列表(包括答案和解析)
4.在常温下,纯水中存在电离平衡H2O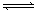 H+ +OH-,若要使水溶液的酸性增强,并使水的电离程度增大,应加入的物质是
H+ +OH-,若要使水溶液的酸性增强,并使水的电离程度增大,应加入的物质是
A.NaHSO4 B.KAl(SO4)2 C.NaHCO3 D.CH3COONa
3.在体积均为1L,pH均等于2的盐酸和醋酸溶液,分别投入0.23g Na,则下图中比较符合反应事实的曲线是
2.(镇江市09第二次调研测试)醋酸是电解质,下列事实能说明醋酸是弱电解质的组合是
①醋酸与水能以任意比互溶 ②醋酸溶液能导电
③醋酸溶液中存在醋酸分子 ④0.1 mol·L-1醋酸的pH比0.1 mol·L-1盐酸pH大
⑤醋酸能和碳酸钙反应放出CO2 ⑥0.1 mol·L-1醋酸钠溶液pH=8.9
⑦大小相同的锌粒与相同物质的量浓度的盐酸和醋酸反应,醋酸产生H2速率慢
A.②⑥⑦ B.③④⑤⑥ C.⑨④⑥⑦ D.①②
1.(镇江市09第二次调研测试)高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数
|
酸 |
HClO4 |
H2SO4 |
HCl |
HNO3 |
|
Ka |
1.6×10-5 |
6.3×10-9 |
1.6×10-9 |
4.2×10-10 |
从以上表格中判断下列说法正确的是
A.在冰醋酸中这四种酸都没有完全电离 B.在冰醋酸中高氯酸是这四种酸中最弱的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4=2 H+ +SO42-
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区别这四种酸的强弱
25.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如右下表: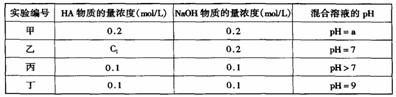 请回答:
请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)的值大小来说明HA是强酸还是弱酸 。
(2)不考虑其它组的实验结果,单从乙组情况分析,C1是否一定等于0.2mol/L (选填“一定”或“不一定”)。
(3)丁组实验所得混合溶液中有关分子或离子浓度的计算关系为:
① c(HA) + c(A-) = mol/L
② - c(A-) = (10-5 -10-9 ) mol/L
24. 草酸晶体的组成可表示为H2C2O4·xH2O,某化学实验小组的同学拟用氧化还原滴定法测定其x值(在酸性条件下样品溶液与KMnO4溶液反应生成CO2和Mn2+),他们设计的具体实验操作过程如下:
① 称取W g纯草酸晶体,将其配制成100.00mL水溶液作为待测溶液;
② 取25.00mL待测溶液放入锥形瓶中,再加入适量的稀硫酸;
③ 用浓度为a mol/L的KMnO4标准溶液进行滴定。
试回答下列问题:
(1)配制a mol/L的KMnO4标准溶液需要的玻璃仪器除容量瓶、烧杯外还有 、 。
(2)实验中应将KMnO4标准溶液装在 式滴定管中,滴定时眼睛应注视 。
(3)滴定时发生的化学反应方程式为 。
滴定达到终点的现象为 。
(4)若所用的KMnO4溶液因久置而浓度变小,则测得的x值会 (偏大、偏小、不变)。
(5)假设经平行滴定操作三次(每次所取待测液体积均相同),平均用去V mL KMnO4溶液,则此滴定所测得草酸溶液的物质的量浓度为 mol/L。
23.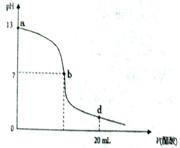 常温下,向20 mL 氢氧化钠溶液中逐滴加入0.2 mol/L醋酸溶液,滴定曲线如下图所示:
常温下,向20 mL 氢氧化钠溶液中逐滴加入0.2 mol/L醋酸溶液,滴定曲线如下图所示:
(1)该氢氧化钠溶液的物质的量浓度为 .
(2)在b点,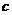 (Na
(Na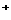 )
)
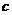 (CH3COO
(CH3COO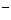 )(填”>”、“<”或“=”)
)(填”>”、“<”或“=”)
(3)氢氧化钠溶液与醋酸溶液恰好完全反应的点位于曲线的 (填选项的蝙号).
A.a点 B.b点 C.d点 D.a、b间的某点
E.b、d间的某点
(4)在d点,溶液中所有离子浓度由大到小的顺序为: .
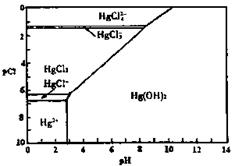
22.水体中二价汞离子可以与多种阴离子结合成不同的存在形态。水溶液中二价汞主要存在形态与 、
、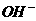 的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=一lgc(
的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=一lgc(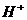 ),pCl=一lgc(
),pCl=一lgc( )]。
)]。
(1)正常海水(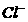 的浓度大于0.1mol/L)
中汞元素的主要存在形态是 。少量Hg(NO3)2溶于0.001mol/L的盐酸后得到无色透明溶液,其中汞元素的主要存在形态是
。
的浓度大于0.1mol/L)
中汞元素的主要存在形态是 。少量Hg(NO3)2溶于0.001mol/L的盐酸后得到无色透明溶液,其中汞元素的主要存在形态是
。
(2)Hg(NO3)2固体易溶于水,但溶于水时常常会出现浑浊,其原因是 (用离子方程式表示),为了防止出现浑浊,可采取的措施是 。
(3)处理含汞废水的方法很多。下面是常用的两种方法,汞的回收率很高。
①置换法:用废铜屑处理含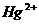 的废水。反应的离子方程式为 。
的废水。反应的离子方程式为 。
②化学沉淀法:用硫化钠处理含Hg(NO3)2的废水,生成HgS沉淀。已知
Ksp(HgS)=1.6X10-52,当废水中c(S2-)=1×10-5mol/L时,c(Hg2+)=
21.下列溶液中有关物质的量浓度关系正确的是
A.10℃时pH=12的NaOH溶液与40℃时pH=12的NaOH溶液中:c(OH-)相等
B.25℃时pH=10的NaOH溶液与pH=10的氨水中: c(Na+)=c(NH4+)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:
 c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D.0.1mol·L-1(NH4)2Fe(SO4)2溶液中:
c(NH4+)+c(Fe2+)+c(NH3·H2O)=0.3 mol·L-1
8.下列溶液中离子浓度的关系一定正确的是
A.Na2CO3和NaHCO3溶液中:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-)
B.一元弱碱MOH对应的盐MCl溶液中:c(Cl-)>c(H+)>c(M+)>c(OH-)
C.等物质的量的一元弱酸HX与其钾盐KX的混合溶液中:2c(K+)=c(X-)+c(HX)
D.pH=3的一元酸HX和pH=11的一元碱MOH等体积混合:
c(M+)=c(X-)>c(H+)=c(OH-)
9.常温下,0.1 mol·L-1某一元酸(HA)溶液中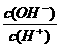 =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
 A.该溶液中由水电离出的c(H+)=1×10-11 mol·L-1
A.该溶液中由水电离出的c(H+)=1×10-11 mol·L-1
 B.浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,
B.浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,
 则c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
则c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
 C.0.1 mol·L-1HA溶液与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中
C.0.1 mol·L-1HA溶液与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中
 c(A-) + c(HA) = c(Na+)
c(A-) + c(HA) = c(Na+)
 D.0.1 mol·L-1HA溶液与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中
D.0.1 mol·L-1HA溶液与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中
 2c(H+)+
c(HA) = c(A-) + 2c(OH-)
2c(H+)+
c(HA) = c(A-) + 2c(OH-)
10.缓冲溶液可以控制少量酸碱对溶液pH的影响,NaH2PO4/Na2HPO4的混合溶液可以将体系的pH稳定在6.2-8.2。下列有关该缓冲溶液的说法正确的是
A.加入少量强碱,发生反应HPO42-+OH- PO43-+H2O
B.加入少量强酸,发生反应HPO42-+H+ H2PO4-
C.c(Na+)+c(H+)=c(OH-)+c(H2PO4-)+2c(HPO42-)
D.2c(Na+)>c(PO43-)+c(HPO42-)+c(H2PO4-)+c(H3PO4)>c(Na+)
11.已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1 mol/L的NaA和NaB混合溶液中,下列排列正确的是:
A.c(OH-)>c(HA)>c(HB)>c(H+) B. c(OH-)>c(A-)>c(B-)>c(H+)
C. c(OH-)>c(B-)>c(A-)>c(H+) D. c(OH-)>c(HB)>c(HA)>c(H+)
12.实验室现有3种酸碱指示剂,其pH变色范围如下
甲基橙:3.1~4.4 石蕊:5.0~8.0 酚酞:8.2~10.0
用0.1000 mol/L NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述中正确的是
A.溶液呈中性,可选用甲基橙或酚酞作指示剂 B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂 D.溶液呈碱性,只能选用酚酞作指示剂
13.下列溶液中有关微粒的物质的量浓度关系正确的是
A.NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):
c(Na+)=c(HRO3-)+2c(RO32-)
B.常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:
c(Na+)>c(Cl-)>c(CH3COOH)
C.常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中c(NH4+):①<③<②
D.等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数多少:N前<N后
14.下列溶液中,各组离子一定能够大量共存的是
 A.无色溶液中:K+、H+、SO32-、MnO4-
A.无色溶液中:K+、H+、SO32-、MnO4-
 B
B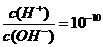 的溶液中:K’、Na+、CO32-、AIO2-
的溶液中:K’、Na+、CO32-、AIO2-
 C能使pH试纸变红的溶液中:Ca2+、Na+、CO32-、SO42-
C能使pH试纸变红的溶液中:Ca2+、Na+、CO32-、SO42-
 D.含有大量Fe3+的溶液中:H+、Mg2+、I-、SCN-
D.含有大量Fe3+的溶液中:H+、Mg2+、I-、SCN-
15.广义的水解观认为,无论是盐的水解还是非盐的水解,其最终结果都是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质。根据上述观点,下列说法中不正确的是
 A CaO2的水解产物是Ca(OH)2和H2O2
A CaO2的水解产物是Ca(OH)2和H2O2
 B(CH3)3COMgBr的水解产物是(CH3)3COH和Mg(OH)Br
B(CH3)3COMgBr的水解产物是(CH3)3COH和Mg(OH)Br
 C
PCl3的水解产物是PH3和HClO
C
PCl3的水解产物是PH3和HClO
 DA1(C2H5)3的水解产物是Al(OH)3与C2H6
DA1(C2H5)3的水解产物是Al(OH)3与C2H6
16.常温下将NaOH溶液与CH3COOH稀溶液混合,不可能出现的结果是
 A. pH=7且c(CH3COO-)>c(Na+)>c(H+)=c(OH-)
A. pH=7且c(CH3COO-)>c(Na+)>c(H+)=c(OH-)
 B. pH<7且c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
B. pH<7且c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
 C .
pH>7且c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C .
pH>7且c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
 D.pH>7且c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.pH>7且c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
17.下列关于电解质溶液的叙述正确的是 ( )
A.常温下,Ph=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为:
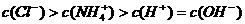

B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C.室温下,CH3COOH分子可存在于pH=8的碱性溶液中
D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大
18.利用相关数据作出的推理或判断一定正确的是
A.用弱酸的电离常数比较相同条件下强碱弱酸盐溶液的碱性强弱
B.用物质熔沸点数据推断出物质的晶体类型
C.根据溶液的pH判断该溶液的酸碱性
D.根据焓变是否小于零判断反应能否自发
19.下列排列顺序正确的是
A.常温下将0.1 mol·L-1 NH4Cl溶液与0.05 mol·L-1 NaOH溶液等体积混合,
c (Cl-)> c (Na+)> c(NH4+)> c (OH-)> c (H+)
B.常温下物质的量浓度相等的①NH4HSO4②CH3COONH4③NH4Cl三种溶液中c(NH4+):①>③>②
C.0.1mol·L-1的NaHA溶液,其pH=11,则溶液中:c(HA-)>c(OH-)>c(A2-)>c(H2A)
D.在相同条件下,将足量AgCl加入等体积的①0.01 mol·L-1 KCl②0.1 mol·L-1 KCl溶液③蒸馏水三种液体中,所能溶解的AgCl质量关系为:①>②>③
20.下列叙述正确的是
A.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2Fe(SO4)2] < c[(NH4)2SO4] < c(NH4Cl)
B.向AgCl悬浊液中滴入KI溶液,有AgI沉淀生成,说明AgCl的溶解度小于AgI的溶解度
C.0.2 mol/L HCl溶液与等体积0.05 mol/L Ba(OH)2溶液混合后,溶液的pH=1
D.0.2 mol/L的NaHCO3溶液中c(H+)+c(H2CO3)=c(CO32-)+c(OH-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com