
题目列表(包括答案和解析)
3.2005年在沪连高速淮安段发生一起盛液氯的槽罐车倾覆事件,后来发现事发地附近的野花都“失色”了,那么最直接导致这一现象出现的物质是
A.氯气 B.氯化氢 C.次氯酸 D.氯离子
2.于谦有诗作《石灰吟》“千锤万凿出深山,烈火焚烧若等闲,粉身碎骨浑不怕,要留青白在人间。”试判断下列说法不正确的是
A.诗中涉及的化学反应至少有3个
B.涉及的反应类型包括化合、分解等
C.生石灰、熟石灰都是碱
D.生石灰是CaO,熟石灰是Ca(OH)2
1.今天距2009年4月8日还有120天左右,经过长达一年多的化学学习,你对化学学科一定有很多深刻的认识。你来判断一下,下列关于化学学科的说法中不正确的是
A.化学是研究物质的组成、结构、性质、变化以及合成的一门科学
B.化学是一门以实验为基础的自然科学
C.化学可以改变分子和制造分子
D.化学知识与人类生产、生活、社会等联系最密切而且贡献最大
25.(9分)我国牛奶行业常用盖尔达法测定牛奶中蛋白质的含量。盖尔达法分解蛋白质的过程可表示为:

 蛋白质
硫酸铵
氨
蛋白质
硫酸铵
氨
现对某液态奶中的蛋白质含量进行测定。取30.0mL牛奶用盖尔达法分解蛋白质,把氮完全转化为氨,用0.500mol/L H2SO450.0mL吸收后,剩余的酸用1.00mol/L NaOH溶液中和,需38.0mL,求:
(1)30.0mL牛奶中共含有多少克氮?
(2)如果蛋白质中含氮16.0%(质量),则牛奶中含蛋白质的质量分数是多少?(已知牛奶的密度是1.03g/mL)
(3)为谋取暴利,掺杂使假已成为不法分子的常用手段。“三鹿”奶粉中的“三聚氰胺”已造成全国许多婴幼儿的肾结石,严重威胁了婴幼儿的生命安全。三聚氰胺的结构用键线式可表示为
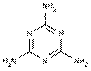 常用于合成密胺塑料。请计算“三聚氰胺”中氮元素的质量分数。
常用于合成密胺塑料。请计算“三聚氰胺”中氮元素的质量分数。
(4)从化学角度分析,不法分子在奶粉中掺入“三聚氰胺”的主要目的是什么?请你用简要的文字对这一事件作出评价。
高二月考化学试题(选修)
24.(8分)判断下列实验操作对中和热测定的数值有如何影响?填变大、变小或者不变。
①大烧杯上没有盖硬纸板_____________________。
②用相同浓度和体积的氨水代替NaOH溶液进行实验_____________________。
③用相同浓度和体积的浓硫酸代替稀盐酸溶液进行实验_____________________ 。
④实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行实验_____________________。
23.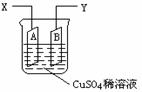 (6分)如图是可用于测量阿伏加德罗常数的装置示意图,其中A、B是两块纯铜片,插在CuSO4稀溶液中,铜片与引出导线相连,引出端分别为X、Y。
(6分)如图是可用于测量阿伏加德罗常数的装置示意图,其中A、B是两块纯铜片,插在CuSO4稀溶液中,铜片与引出导线相连,引出端分别为X、Y。
⑴ 当以I=0.21A的电流电解60min后,测得铜片A的质量增加了0.25g,则图装置中的X端应与直流电的 极相连,它是电解池的 极。
⑵ 电解后铜片B的质量 (答“增加”、“减少”或“不变”)。
⑶ 列式计算实验测得的阿伏加德罗常数NA=______________________。
(不要求写出结果,保留原始数据和计算式,已知电子电量e=1.60×10–19C)
22.(6分)已知热化学方程式:
Mg(OH)2(s)=MgO(s)+H2O(g) △H1=+81.5kJ·mol-1
Al(OH)3(s)=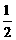 Al2O3(s)+
Al2O3(s)+ H2O(g) △H2=+87.7kJ·mol-1
H2O(g) △H2=+87.7kJ·mol-1
①Mg(OH)2和Al(OH)3起阻燃作用的主要原因是 。
②等质量Mg(OH)2和Al(OH)3相比,阻燃效果较好的是 ,
原因是 。
21.(4分)(1)把一小块镁、铝合金放入 6 mol·L-1的NaOH溶液中,可以形成微型原电池。则该原电池负极上发生的电极反应为 ;
(2)我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为:4A1+3O2+6H2O=4A1(OH)3,正极反应式为
。
20.(12分)在火箭推进器中装有强还原剂肼(N2H4)和氧化剂H2O2,当它们混合时即产生大量N2和水蒸气并放出大量热。已知0.4mol N2H4(1)与足量H2O2(1)反应生成N2和水蒸气放出256.65kJ的热量。
 (1) 写出N2H4和H2O2
的结构式:
(1) 写出N2H4和H2O2
的结构式:
N2H4___________ H2O2 _______________。
(2) 写出反应的热化学方程式______________________________________。
(3) 已知H2O(g)==H2O(1) △H=-44kJ/mol,则16g液态肼与足量H2O2(1)反应生成N2和液态水时,放出热量:_________kJ。
(4) 上述反应用于火箭推进器,除释放出大量热和快速产生大量气体外,还有一个很突出的特点是:__________________。
19.(12分)(1)已知:NaOH(aq)+HCl(aq) = NaCl(aq)+H2O(1) DH1=-57.4kJ/mol
Ca(OH)2 (aq) + H2SO4 (aq) =CaSO4 (s) + 2H2O (l) DH2=-130 .20kJ /mol
导致2DH1 不等于DH2的原因是________________。
(2)化学键的键能是原子间形成1mol化学键(或其逆过程)时释放(或吸收)的能量。以下是部分共价键键能数据:H-S 364kJ·mol-1;S-S 266kJ·mol-1;
O=O ,496kJ·mol-1;H-O 464kJ·mol-1。
 已知:
已知:
2H2S(g)+O2(g)=2S(g)+2H2O(g) △H1
2H2S(g)+3O2(g)=2SO2+2H2O(g) △H2=-1000kJ·mol-1
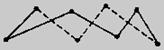
反应产物中的S实为S8分子,是一个八元环状分子(如图)
①试根据上述数据计算可得△H1= kJ·mol-1
②将a mol H2S与b mol O2混合进行上述反应,当a>2b时,反应放热 kJ,
将a mol H2S与b mol O2混合进行反应,当3a<2b时,反应放热 kJ。
(3) 已知A、B两气体在一定条件下可发生反应:2A+B=C+3D+4E,现将相对分子质量为M的A气体mg与适量B充入一密闭容器中恰好完全反应后,有少量液滴生成,在相同温度下测得反应前后压强分别为6.06×106Pa和1.01×107Pa,又测得反应共放热QKJ,试根据以上事实写出该热化学反应方程式__________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com