
题目列表(包括答案和解析)
5.在一定温度、一定容积的密闭容器中,反应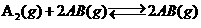 ,达到平衡的标志是
,达到平衡的标志是
A.单位时间内生成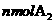 的同时也生成
的同时也生成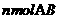
B.容器内的压强不受时间变化的影响
C.单位时间内生成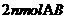 的同时也生成
的同时也生成
D.单位时间内生成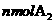 的同时也生成
的同时也生成
4.在25℃和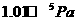 时,
时, ;
;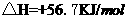 ,
,
能自发进行的合理解释是
A.是吸热反应 B.是放热反应
C.是熵减反应 D.是熵增效应大于能量效应
3.已知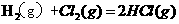
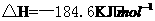 ,则反应
,则反应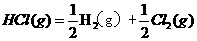
的△H为
A.+184.6 B.一92.3S
B.一92.3S
C.一369.2 D.+92.3
D.+92.3 
2.升高温度能加快反应速率的主要原因是
A.活化分子能量明显增加 B.降低活化分子的能量
C.增加活化分子百分数 D.降低反应所需要的能量
1.下列叙述正确的是
A.电能是二次能源 B.水力是二次能源
C.天然气是二次能源 D.水煤气是一次能源
29、(15分)某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A = H+ + HA-
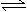 HA-
H+ + A2-
HA-
H+ + A2-
回答下列问题:
(1)用离子方程式表示Na2A溶液显“酸性”“或中性”或“碱性”的原因____________ __
(2)在0.1mol.L-1的Na2A溶液中,下列微粒浓度关系式正确的是__________
A. c(A2-) +c( HA-)+c( H2A) =0.1mol·L-1
B. c(OH-)=c(H+) +c( HA-)+2c(H2A)
C. c(Na+ )+ c(H+) =c(OH-)+ c( HA-)+2c(A2-)
D. c(Na+ ) >c(A2-)>c( HA-) >c(OH-) >c(H+)
(3)常温下,已知0.1mol·L-1NaHA溶液的pH=2,则当H2A溶液中c(H+)为0.11 mol·L-1时,H2A溶液的物质的量浓度应_______ ___ ___ _ 0.1mol/L(填“>”或“<”或“=”); 理由是 。
(4)比较①0.1mol·L-1 Na2A溶液 ②0.1mol·L-1 Na2SO4溶液,两种溶液中阴离子总浓度的大小① ②(填“>”或“<”或“=”)。
28、(9分)有A、B、C、D四种短周期元素,A、B、C为同一周期且相邻。A和C的原子序数之比为3 :4,A、B、C分别与D形成的化合物分子的电子总数相等。
⑴ 写出上述三种化合物分子中常温下呈气态的极性分子的实验室制备方法:
;
⑵ B、C、D三元素可组成化学式为D4B2C3的离子化合物,该化合物的水溶液pH 7(填“>”、“<”、“=”)用离子方程式解因: 。
⑶ 四种元素共同组成的化合物中,既能与盐酸反应又能与NaOH溶液反应且相对分子质量最小的无机物的化学式为 ;并写出该物质与足量的NaOH溶液在加热条件下的离子方程式 。
27、(14分)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
① 将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2-3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;
② 将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;
③ 向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至终点,测得所耗盐酸的体积为V1mL;
④ 重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1) 滴定终点时的现象为锥形瓶中的溶液由 ________。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察__________________________;
 (3)该小组在步骤①中的错误是_________,由此造成的测定结果___________ (填偏高、偏低或无影响);
(3)该小组在步骤①中的错误是_________,由此造成的测定结果___________ (填偏高、偏低或无影响);
(4)步骤②缺少的操作是_______ __ _ _;
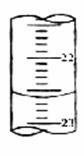
(5)右图,是某次滴定时的滴定管中的液面,其读数为___________mL;
(6)根据下列数据:
 滴定次数 滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
|
滴定前读数(mL) |
滴定后读数(mL) |
||
|
第一次 |
25.00 |
0.40 |
20.38 |
|
第二次 |
25.00 |
4.00 |
24.02 |
待测烧碱溶液的物质的量浓度是 (保留有效数字)。
26、(21分)(1)实验室在临时配制一些FeCl2的溶液时,常将氯化亚铁固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,是为了 。稀释后还需要加入一些铁粉,其目的是 ,相关反应的离子方程式为 。
(2)氯化铁水溶液呈 性 ,原因是(用离子方程式表示):____________ ____ 。把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。如果要从氯化铁溶液得到纯氯化铁固体,常采用的方法是 。
13、盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是( )
A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO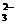 和OH-
和OH-
B.NaHCO3溶液中:c(HCO3)+c(OH-)
+c(CO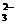 )= c(H+)+ c(Na+)
)= c(H+)+ c(Na+)
C.10 mL0.10mol·L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com