
题目列表(包括答案和解析)
1.下列说法正确的是( )
A.反应焓变是指1mol物质参加反应时的能量变化
B.当反应放热时,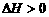 ,反应吸热时,
,反应吸热时,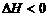
C.在加热条件下发生的反应均为吸热反应
D.一个化学反应中,当反应物能量大于反应产物能量时,反应放热, 为“-”
为“-”
32、(7分)在密闭容器中将NO2加热到某温度时,进行如下的反应:2NO2 2NO+O2,反应5分钟后达平衡,测得平衡时各组分的浓度分别为:c(NO2)=0.06 mol/L,c(NO)=0.24
mol/L。试求:⑴NO2的转化率为? ⑵反应开始时与平衡时的压强比为多少?
2NO+O2,反应5分钟后达平衡,测得平衡时各组分的浓度分别为:c(NO2)=0.06 mol/L,c(NO)=0.24
mol/L。试求:⑴NO2的转化率为? ⑵反应开始时与平衡时的压强比为多少?
⑶用O2来表示的反应速率是多少mol·L-1·min-1


30.(6分)现有①硫酸溶液、②醋酸溶液、③盐酸三种溶液,请用①、②、③填空:
(1)当pH值相等时,三种酸的物质的量浓度由大到小的顺序是__________。
(2)当物质的量浓度相等时,三种酸溶液的pH值由大到小的顺序是_________。
 (3)25℃时,取pH值都等于3的①、②、③三种溶液各100mL,分别向其中加入10mLpH=12的Ba(OH)2溶液,反应后pH值最小的是___________。
(3)25℃时,取pH值都等于3的①、②、③三种溶液各100mL,分别向其中加入10mLpH=12的Ba(OH)2溶液,反应后pH值最小的是___________。
31(12分)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有以下几种:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
(1)上述关系一定不正确的是 (填序号)。
(2)若溶液中只有一种溶质,则该溶质为 ,该溶液中离子浓度的大小关系
为 --- (填序号)。
(3)若关系③正确,则溶液中溶质为 。
(4)若四种离子浓度关系有c(NH4+)=c(Cl-),则该溶液显 (填“酸性”、“碱性”、“中性”)。
(5)25℃,pH=a的盐酸VamL与pH=14-a的氨水VbmL混合,若溶液显中性,则
Va Vb (填“大于”、“小于”、等于”或“无法确定”)。
29.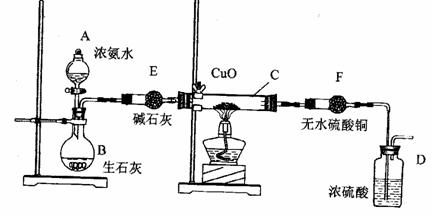 (9分)某课外活动小组在实验室用下图的一些装置组合后,快速制取氨并验证氨的某些性质,同时收集少量纯净氮气,请回答:
(9分)某课外活动小组在实验室用下图的一些装置组合后,快速制取氨并验证氨的某些性质,同时收集少量纯净氮气,请回答:
(1)写出用熟石灰和氯化氨反应制氨气的化学方程式
。
(2) 本实验进行一断时间后,观察到加热的硬质玻璃试管内黑色氧化铜粉末转为红色,盛无色硫酸铜的干燥管内出现蓝色,并且在最后的出气导管处收集到纯净、干燥的氮气。根据这些现象,写出在硬质玻璃试管内发生反应的化学方程式:________________ _,这个反应说明氨气具有________ (填编号)
A、碱性 ; B、还原性; C、氧化性能; D、不稳定性
(3) 洗气瓶中盛浓硫酸的主要作用是_____________ ___。
(4) 在最后的出气的导管口收集干燥、纯净的氮气,收集方法是:____ _______。
(填编号: A、排气法 B、排水法 C、用气囊收集)
(5)装置E的作用是___________ ____。装置F的作用是 ___________________。
28、
 (5分)在一定条件下,可逆反应A + B
(5分)在一定条件下,可逆反应A + B  mC.变化右图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问:
mC.变化右图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问:
(1)温度T1 T2(填大于、等于或小于)
(2)正反应是 反应(填“吸热”或“放热”)
(3)如果A、B、C均为气体,则m 2;(填大于、等于或小于)
(4)当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,则体系的压强 ---- (填增大、减小或不变),平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”)。
27、(5分)亚硝酸钠(NaNO2)又称工业盐,其外观类似食盐,但有剧毒。近年来,建筑工地多次发生民工误食工业盐而中毒的事件。利用如下反应可鉴别NaNO2和NaCl。
___KMnO4+___NaNO2+___H2SO4=___MnSO4+___K2SO4+___NaNO3+___H2O
(1)配平上述反应的化学方程式;(2分)
(2)指出该反应的氧化剂 ;(1分)
(3)当有2mol电子转移,则有 mol还原剂被氧化。(2分)
26.(6分)现有PH=12的NaOH溶液100ml,要使它的PH降为11。
(1)如果加入蒸馏水,应加 ml
(2)如果加入PH=10的NaOH溶液,应加 ml
(3)如果加入0.01mol/L的盐酸,应加入 ml
25.等物质的量浓度的下列五种溶液,1CH3COOH 2(NH4)2CO33NaHSO44NaHCO35Ba(OH)2,溶液中水的电离程度由大到小排列正确的是( )。
A.53142 B. 35124
C.24315 D. 24135
雅安中学09-10学年高二上学期九月月考
化 学 试 题
(考试时间90分钟,满分100分)
第Ⅱ卷(共50分)
24.室温时,某溶液中由水电离生成的H+和OH-物质的量浓度的乘积为10-24,则在该溶液中一定不能大量共存的离子组是( )。
A.Al3+、Na+、NO3-、Cl- B.K+、Na+、Cl-、CO32-
C.NH4+、Na+、Cl-、SO42- D.NH4+、K+、SiO32-、NO3-
23.常温下,某一元强酸HA和一元弱碱BOH的pH之和为14,有关这两种溶液混合的说法中不正确的是( )。
A.混合之前两种溶液中由水电离产生的c(H+)相同
B.若混合后恰好完全中和,反应液中水的电离程度比纯水中大
C.若混合后溶液呈中性(pH=7),则V(HA)> V(BOH)
D.等体积混合两种溶液,反应后因生成强酸弱碱盐而使溶液呈酸性
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com