
题目列表(包括答案和解析)
23.(8分)(1)某研究性学习小组对“钠在空气中燃烧的产物”进行了探究。其实验过程是:取一小块钠在空气中加热片刻后与一定量的水反应,收集到VmL气体(标准状况),向所得溶液中滴入1.000mol•L-1的盐酸30.00mL恰好中和完全(如图所示)。试回答:
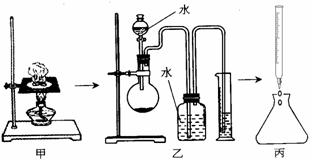
①甲、乙、丙三套装置共有________处错误;
②丙操作中,若以酚酞作指示剂,滴定终点时锥形瓶内溶液颜色变化是 ;
③若V=168mL(标准状况),在一定条件下将其引燃,恰好完全反应。请将钠块在空气中加热片刻后所得到的固体成分及质量填在下表(表格可不填满也可补充):
|
成 分 |
|
|
|
|
质量/g |
|
|
|
(2)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂和被滴定物的生成物的溶解度要比滴定剂和指示剂生成物的溶解度_____(填“大”、“小”、“相同”),否则不能用这种指示剂。如用AgNO3溶液滴定溶液中的Cl-的含量时常以CrO42-为指示剂,这是因为AgCl比Ag2CrO4更____(填“难”、“易”)溶的缘故。
镇江市2008-2009六校教学质量调研
高二化学评分标准
22.(12分)带支链的烷烃A(C6H14)只可能有三种一氯取代产物B、C和D,以上反应及B的进一步反应如下图所示。
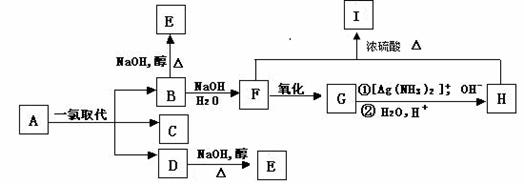
请回答:
⑴A的名称是 ,I的分子式是 ;
⑵B转变为E的反应属于 反应(填反应类型名称);
F和H生成I的反应属于 反应(填反应类型名称)。
⑶写出下列反应的化学方程式:
B→F: ;
D→E: ;
⑷将1molA的一氯取代物的混合气体充分燃烧,生成CO2、H2O和HCl,则需氧气 mol;
⑸某一有机物X是H的同分异构体,可发生下列变化:
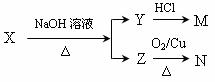
已知M为羧酸,且M、N均不发生银镜反应,则X的可能结构有__________________种;写出Z可能的结构简式: 。
21.(8分)经研究发现有白蚁信息素有: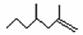 (2,4-二甲基-1-庚烯) ,
(2,4-二甲基-1-庚烯) , 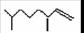 (3,7-二甲基-1-辛
(3,7-二甲基-1-辛 烯),家蚕的性信息素为:CH3(CH2)2CH=CH-CH=CH(CH2)8CH3。试完成下列问题:
烯),家蚕的性信息素为:CH3(CH2)2CH=CH-CH=CH(CH2)8CH3。试完成下列问题:
⑴下列说法正确的是 ;
A.以上三种信息素互为同系物 B.以上三种信息素均能使溴的四氯化碳溶液褪色
C.2,4-二甲基-1-庚烯与3,7-二甲基-1-辛烯互为同系物 D.家蚕信息素与1molBr2加成产物只有一种
 ⑵烯烃A是2,4-二甲基-1-庚烯的一种同分异构体,A与足量氢气加成得到烷烃B,B的一氯代物只有2种;烯烃C是3,7-二甲基-1-辛烯的一种同分异构体,C与氢气加成得到烷烃D,D的一氯代物也只有2种,则:
⑵烯烃A是2,4-二甲基-1-庚烯的一种同分异构体,A与足量氢气加成得到烷烃B,B的一氯代物只有2种;烯烃C是3,7-二甲基-1-辛烯的一种同分异构体,C与氢气加成得到烷烃D,D的一氯代物也只有2种,则:
B的结构简式为 ;C的结构简式为 ;
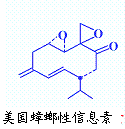
⑶美国蟑螂性信息素结构式如右图,分子中含有手性碳原子 个;有机物E与该信息素互为同分异构体,E能发生银镜反应又能与碳酸氢钠溶液反应,若E表示为: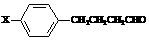 ,X可能的结构有
种。
,X可能的结构有
种。
20.(10分)已知A、E、I、L是常见的非金属单质,其中A为淡黄色固体,Z是常见的金属单质,B的相对分子质量比A大32,C的相对分子质量比B大16,Y是一种常见的液体,J是磁铁矿的主要成分,D、H、K均是重要的工业产品,X分子的球棍模型如图所示,图中部分反应条件已略去。试回答下列问题:
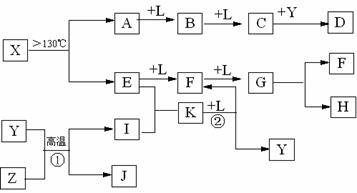
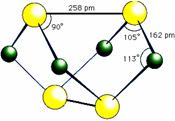
⑴写出化学式:D: ,X : ;
⑵E的电子式为: ;
⑶写出化学方程式:① ;② 。
19.(8分) 合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:N2(g)+3H2(g)
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:N2(g)+3H2(g) 2NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:
2NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:
催化剂-铁触媒,温度-400-500℃,压强-30-50MPa。
回答下列问题:
⑴合成氨工业中原料气压缩到30-50MPa的原因是 ,从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400-500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是 ;
⑵500℃、50MPa时,在容积为VL的容器中加入n mol N2、3n mol H2,反应达平衡后测得平衡常数为K,此时N2的转化率为x。则K和x的关系满足K= ;
⑶甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)。部分物质的燃烧热数据如下表:
|
物 质 |
燃烧热(kJ·mol-1) |
|
H2(g) |
-285.8 |
|
CO(g) |
-283.0 |
|
CH4(g) |
-890.3 |
已知1mol H2O(g)转变为1mol H2O(l)时放出44.0 kJ热量。写出CH4和H2O在高温下反应的热化学方程式 ;
⑷有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池。请写出该电池的正极反应式 。
18.(12分)实验室常用邻苯二甲酸氢钾(KHC8H4O4)来滴定氢氧化钠的的浓度,反应如下:KHC8H4O4 + NaOH = KNaC8H4O4
+ H2O。若氢氧化钠的溶液浓度为0. 1mol·L-1,到达终点时,溶液的PH约为9.1。⑴为标定氢氧化钠溶液的浓度,应选
用作指示剂,达到滴定终点时溶液由 色变为
色;⑵ 在测定氢氧化钠溶液浓度时,有下列操作:①向溶液中加入1-2滴指示剂;②向锥形瓶中加20-30ml蒸馏水溶解;③用氢氧化钠溶液滴定到终点,半分钟不褪色④重复以上操作;⑤准确称取0.4-0.5g邻苯二甲酸氢钾加入250ml锥形瓶中;⑥根据两次实验数据计算氢氧化钠的物质的量浓度;
在测定氢氧化钠溶液浓度时,有下列操作:①向溶液中加入1-2滴指示剂;②向锥形瓶中加20-30ml蒸馏水溶解;③用氢氧化钠溶液滴定到终点,半分钟不褪色④重复以上操作;⑤准确称取0.4-0.5g邻苯二甲酸氢钾加入250ml锥形瓶中;⑥根据两次实验数据计算氢氧化钠的物质的量浓度;
以上各步中,正确的(填序号)操作顺序是 ;
⑶上述操作中,将邻苯二甲酸氢钾直接放到锥形瓶中溶解,对实验是否有影响? ;
并说明理由: ;
⑷滴定前,用蒸馏水洗净碱式滴定管,然后加待测定的氢氧化钠溶液滴定,此操作对实验结果
(填“偏大”“偏小”或“无影响”);
⑸现准确称取KHC8H4O4(分子量204.2)晶体0.5105g,溶于水后加入指示剂,用NaOH溶液滴定至终点,消耗NaOH 20 mL,则NaOH溶液的物质的量浓度为 (结果保留四位有效数字)。
17.(4分)下列有关化学实验的正确组合是 。
①除去苯中的苯酚:向溶液中加入浓溴水,过滤;
②除去乙酸乙酯中少量乙酸,可用饱和碳酸钠溶液洗涤、分液、蒸馏;
③用碱式滴定管量取20.00 mL 0.1000 mol / L KMnO4溶液;
④配制氯化铁溶液时,往往先把氯化铁固体溶于浓盐酸中,再加适量蒸馏水稀释,最后再加少量铁粉;
⑤不慎将苯酚溶液沾到皮肤上,应立即用酒精清洗;
⑥在进行中和滴定实验时,锥形瓶必须先用蒸馏水洗涤后,再用待测液润洗;
16.某化合物的结构(键线式)及球棍模型如下:
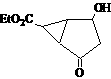
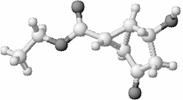
该有机分子的核磁共振波谱图如下(单位是ppm)。
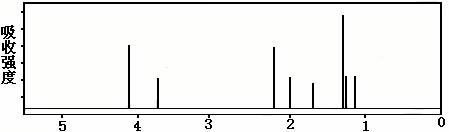
下列关于该有机物的叙述正确的是:
A.该有机物不同化学环境的氢原子有8种 B.该有机物属于芳香族化合物
C.该有机物在一定条件下能够发生消去反应 D.键线式中的Et代表的基团为-CH3
第Ⅱ卷(选择题 共64分)
15.已知在pH值为4左右的环境中,Ca2+、Fe2+几乎不水解,而Fe3+几乎完全水解。工业上制CuCl2是将浓盐酸用蒸气加热到80℃左右,再慢慢加入粗氧化铜(含少量杂质FeO),充分搅拌使之溶解。欲除去溶液中的杂质离子,下述方法中可行的是
A.加入纯Cu将Fe2+还原为Fe
B.向溶液中通入H2S使Fe2+沉淀
C.向溶液中通入Cl2,再通入NH3,调节pH值为4左右
D.向溶液中通入Cl2,再加入纯净的CuO粉末调节pH值为4左右
14.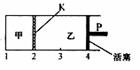 一定温度下可逆反应:A(s)+2B(g)
一定温度下可逆反应:A(s)+2B(g) C(g)+D(g)
△H<0。现将1mol A和 2molB加入甲容器中,将2 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图所示,隔板K不能移动)。下列说法正确的是
C(g)+D(g)
△H<0。现将1mol A和 2molB加入甲容器中,将2 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图所示,隔板K不能移动)。下列说法正确的是
A.保 持温度和活塞位置不变,甲中再加入1 mol A和2mol B,达到新的平衡后,c(B)甲=2c(B)乙
持温度和活塞位置不变,甲中再加入1 mol A和2mol B,达到新的平衡后,c(B)甲=2c(B)乙
B.保持温度和乙中压强不变 ,向乙中加入2 mol D,达到新平衡后,c(B) 乙≤2c(B) 甲
C.若该温度下反应的K=1,则甲中B和乙中C的转化率均为66.7%
D.保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com