
题目列表(包括答案和解析)
(一)(7分)、将氧化还原反应 Zn + Cu2+ = Cu + Zn2+设计成原电池:
①负极材料为:______________________;负极反应:______________________;
②正极材料为:____________________电解质溶液为:______________________
正极反应:____________________________________________
③画出原电池简图:
11.在由水电离产生的c (H+)=1×10-14mol·L-1的溶液中,一定能大量共存,且溶液为无
色的离子组的是
A.NH4+、Fe2+、Cl-、NO3- B.Na+、Ba2+、Cl-、NO3-
C.K+、Mg2+、HCO3-、SO42- D.K+、Na+、MnO4-、SO42-
12、常温时,向pH=2的硫酸中加入等体积的下列溶液后,滴入石蕊溶液,出现红色,该溶液可能是
A.pH=12的Ba(OH)2 B.pH=12的氨水
C.0.05 mol•L-1 NaOH D.0.05 mol•L-1 BaCl2
13.下列离子方程式书写正确的是
A.Na2S溶液的水解:S2-+ 2H2O H2S + 2OH-
H2S + 2OH-
B.NaHCO3溶液的电离:HCO3-+
H2O H2 CO3+ OH-
H2 CO3+ OH-
C.NH4Cl溶液的水解:NH4+
+ H2O NH3·H2O + H+
NH3·H2O + H+
D.把金属铁放入稀硫酸中:2 Fe + 6H+ = 2Fe3+ + 3 H2↑
14.用已知浓度的NaOH溶液滴定未知浓度的盐酸溶液,下列操作会使测定结果偏低的是
A.滴定前对碱式滴定管仰视读数,滴定后又俯视
B.滴定前锥形瓶内含有少量水
C.滴定前,碱式滴定管尖嘴部分有气泡,滴定后气泡消失
D.碱式滴定管用蒸馏水洗净后,直接装入已知浓度的NaOH溶液
15.用惰性电极分别电解下列各物质水溶液一段时间后,向剩余电解质溶液中加入适量水,
能使溶液恢复到电解前浓度的是
A.AgNO3 B.Na2SO4 C.CuCl2 D.HCl
16.某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是
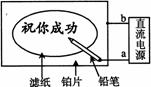 A.铅笔端作阳极,发生还原反应
A.铅笔端作阳极,发生还原反应
B.铂片端作阴极,发生氧化反应
C.铅笔端有少量的氯气产生
D.a点是负极,b点是正极
17.下列各离子浓度的大小比较,正确的是
A.同浓度下列溶液中:① (NH4)2SO4 ② NH4HCO3 ③ NH4Cl ④ NH3·H2O,
c(NH4+)由大到小的顺序是:① > ③ > ② > ④
B.常温时,将等体积的盐酸和氨水混合后,pH = 7,则c (NH4+) > c (Cl-)
C.0.2 mol·L-1 Na2CO3溶液中:c (OH-) = c (HCO3-) + c (H+) + c (H2CO3)
D.0.01 mol·L-1 的NH4Cl溶液与0.05mol·L-1 的NaOH溶液等体积混合:
c (Cl-)> c (NH4+)> c (Na+)>c (OH-)>c (H+)
18.在容积不变的密闭容器中,一定条件下发生反应:2A(?) B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是
B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是
A.若正反应是吸热反应,则A为非气态
B.若正反应是放热反应,则A为非气态
C.在平衡体系中加入少量C,该平衡向逆反应方向移动
D.改变压强对该平衡的移动一定无影响
19. 在密闭容器中进行可逆反应,A与B反应生成C,其反应速率分别用υ(A)、υ(B)、υ(C)(mol·L-1·s-1)表示,且υ(A)、υ(B)、υ(C)之间有如下所示的关系: υ(B)=3υ(A); 3υ(C)=2υ(B)。则此反应可表示为
A.2A+3B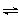 2C B.A+3B
2C B.A+3B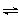 2C
2C
 C.3A+B
C.3A+B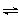 2C D.A+B
2C D.A+B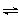 C
C
20.在室温下,等体积的酸和碱的溶液混合后,pH一定少于7的是
A.pH=3的HNO3跟pH=11的KOH溶液
B.pH=3的盐酸跟pH=11的氨水
C.pH=3硫酸跟pH=11的氢氧化钠溶液
D.pH=3的醋酸跟pH=11的氢氧化钠溶液
第Ⅱ卷(非选择题,共 50分)
21:(11分)
10.在下列溶液中,BaSO4的溶解度最大的是
A.1mol/LH2SO4溶液 B.2mol/LNa2SO4溶液
C.纯水 D.0.1mol/L BaCl2溶液
9.在铁制品上镀一定厚度的锌层,以下方案设计正确的是
A.锌作阳极,镀件作阴极,溶液中含有锌离子
B.铂作阴极,镀件作阳极,溶液中含有锌离子
C.铁作阳极,镀件作阴极,溶液中含有亚铁离子
D.锌作阴极,镀件作阳极,溶液中含有锌离子
8.刻度“0”在上方的用于测量液体体积的仪器是
A.滴定管 B.量筒 C.容量瓶 D.烧杯
7.下列说法正确的是
A.HCl溶液中无OH-
B.NaOH溶液中无 H+
C.NaCl溶液中既无OH-也无H+
D.常温下,任何物质的水溶液中都由H+和OH-,且Kw= c(H+)·c(OH-)=10-14
6.可逆反应达到平衡的重要特征是
A.反应停止了 B.正、逆反应的速率均为零
C.正、逆反应都还在继续进行 D.正、逆反应的速率相等
5.下列事实不能用勒夏特列原理解释的是
A.将氯化铁溶液加热蒸干最终得不到氯化铁固体
B.钢铁在潮湿的空气中容易生锈
C.实验室可用排饱和食盐水的方法收集氯气
D.常温下,将1 mL pH=3的醋酸溶液加水稀释至l00 mL,测得其pH < 5
4.对于A2 + 3B2 2C的反应来说,以下化学反应速率的表示中,反应速率最快的是
2C的反应来说,以下化学反应速率的表示中,反应速率最快的是
A.v(B2) = 0.8mol·L-1·s-1 B.v(A2) = 0.4mol·L-1·s-1
C.v(C) = 0.6mol·L-1·s-1 D.v(B2) = 42mol·L-1·min-1
3.决定化学反应速率的主要因素是
A.反应物的浓度 B.反应温度
C.使用催化剂 D.反应物的性质
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com