
题目列表(包括答案和解析)
5.若NA为阿伏加德罗常数的值,下列说法中正确的是 ( )
A.在反应CaO+3C CaC2+CO↑中,生成1 mol CO,转移的电子数为3NA
B.标准状况下,22.4LN2和NO的混合气体所含的原子数为2NA
C.在78g Na2O2粉末中,阴阳离子总数为4NA
D.1mol NH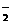 中含电子数为9NA
中含电子数为9NA
4.下列有关实验操作的说法正确的是 ( )
A.可用25 mL碱式滴定管量取20.00 mL KMnO4 溶液
B.用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸
C.蒸馏时蒸馏烧瓶中液体的体积不能超过容积的2/3,液体也不能蒸干
D.将金属钠在研体中研成粉末,使钠与水反应的实验更安全
3.下列推断合理的是 ( )
A.明矾[KAl(SO4)2•12H2O]在水中能形成Al(OH)3胶体,可用作净水剂
B.金刚石是自然界中硬度最大的物质,不可能与氧气发生反应
C.浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应
D.将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色
2.镁、铝、铜三种金属粉末混合物, 加入过量盐酸充分反应, 过滤后向滤液中加入过量烧碱溶液, 再过滤, 滤液中存在的离子有 ( )
A.AlO2- B.Cu2+ C.Al3+ D.Mg2+
1.下列说法不正确的是 ( )
A.从海带中提取碘单质的过程涉及氧化还原反应
B.往淡水中加入NaCl等配成人造海水,可用于海产品的长途运输
C.赤潮主要是由工农业生产和生活废水引起沿海水域的富营养化而造成的
D.海洋经济“金属区”的资源开发可获得Fe、Co、K、Au、Mg、B等金属
24、如图所示装置,两玻璃管中盛满滴有酚酞溶液的NaCl饱和溶液,C(I)、C(II)为多孔石墨电极。
接通S1后,C(I)附近溶液变红,两玻璃管中有气体生成。
两电极的电极反应式C(I) C(II) 。
溶液变红的原因 。
一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:
C(I)的电极名称是 (填写正极或负极);C(II)的电极反应式是 。
23、12分)、恒温下,将a mol N2与b mol H2的混合气体通入一个固体容积的密闭容器中,发生如下反应:
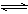 N2(g)+3H2(g) 2NH3(g)
N2(g)+3H2(g) 2NH3(g)
(1)若反应进行到某时刻t时,nt(N2)=13 mol,nt(NH3)=6 mol,计算a的值。
(2)反应达到平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),
n(始):n(平)= 。
(4)原混合气体中,a:b= 。
(5)达到平衡时,N2和H2的转化率之比,a(N2):a(H2)= 。
 (6)平衡混合气体中,n(N2):n(H2):n(NH3)=
(6)平衡混合气体中,n(N2):n(H2):n(NH3)=
22、下列图一、图二是铁钉在水中被腐蚀的实验,数天后
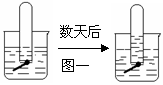
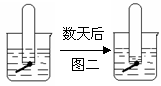
(1)上述两装置中铁钉发生变化的共性是:______________________
(2)图一说明原溶液呈_______________,铁钉发生_________腐蚀,
电极反应为:负极:_______________ ; 正极:___________________
(3)图二说明原溶液呈____________,铁钉发生________腐蚀,
电极反应为:负极: ______________; 正极:________________。
21、
 (8分)、反应2A B+C,在某一温度时,达到平衡。
(8分)、反应2A B+C,在某一温度时,达到平衡。
(1)若温度升高,化学平衡正向移动,则正反应是_____热反应;
(2)若B是固体,降低压强时,平衡逆向移动,则A是_____态;
(3)若A是气态,加压时,平衡不移动,则B为___________态,C为___________态。
21.右图中,两电极上发生的电极反应为:
a极:Cu2+ + 2 e-= Cu b极:Fe - 2 e-= Fe2+
下列说法中不正确的是
A.该装置可能是电解池 B.a极上一定发生还原反应
C.a、b可能是同种电极材料D.该过程中能量的转换一定是化学能转化为电能
选择题答案
卷Ⅱ(非选择题 共40分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com