
题目列表(包括答案和解析)
15.某温度下,在容积固定的密闭容器中发生可逆反应:A(g)+2 B(g)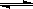 2 R(g) (正反应放热) 。平衡时,容器中各物质的浓度比为c(A)∶c(B)∶c(R)=1∶1∶6。若往容器中再充入0.1 mol A、0.1 mol B、0.6 mol R。下列叙述正确的是:
A.充入时,反应速率v正增大,v逆减小
B.达到新的平衡时,容器内温度下降
C.达到新的平衡时,反应混合物中A、B的体积分数增加
D.达到新的平衡时,c(B)∶c(R)<1∶6
2 R(g) (正反应放热) 。平衡时,容器中各物质的浓度比为c(A)∶c(B)∶c(R)=1∶1∶6。若往容器中再充入0.1 mol A、0.1 mol B、0.6 mol R。下列叙述正确的是:
A.充入时,反应速率v正增大,v逆减小
B.达到新的平衡时,容器内温度下降
C.达到新的平衡时,反应混合物中A、B的体积分数增加
D.达到新的平衡时,c(B)∶c(R)<1∶6
14.下列关于纯净物、混合物、强电解质、弱电解质和非电解质的正确组合是
|
|
纯净物 |
混合物 |
强电解质 |
弱电解质 |
非电解质 |
|
A |
盐酸 |
醋酸 |
碳酸 |
氨水 |
氯气 |
|
B |
纯碱 |
碘酒 |
苛性钾 |
CH3COOH |
干冰 |
|
C |
石灰石 |
空气 |
硫酸 |
磷酸 |
水 |
|
D |
烧碱 |
天然气 |
氯化钠 |
硝酸钠 |
蔗糖 |
13.实验室将I2溶于KI溶液中,配制浓度较大的碘水,主要是因为发生了反应: I2(aq)+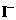 (aq)
(aq)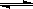
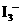 (aq)上述平衡体系中,
(aq)上述平衡体系中,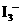 的物质的量浓度c(
的物质的量浓度c(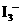 )与温度T的关系如右图所示(曲线上的任何一点都表示平衡状态),下列说法不正确的是
A.该反应的正反应是吸热反应
B.A点与C点的化学反应速率VA < VC
C.在反应进行到D点时, V正 > V逆
D.A点与B点相比,B点的c(I2)大
)与温度T的关系如右图所示(曲线上的任何一点都表示平衡状态),下列说法不正确的是
A.该反应的正反应是吸热反应
B.A点与C点的化学反应速率VA < VC
C.在反应进行到D点时, V正 > V逆
D.A点与B点相比,B点的c(I2)大
12.下列说法错误的是
A.对于反应C(s) + CO2 (g) 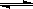 2CO(g) (正反应吸热),升高温度会加快化学反应速率
B.合成氨反应中,当3v(NH3)正=2v(H2)逆时,反应达到平衡
C.对于反应PCl5(g)
2CO(g) (正反应吸热),升高温度会加快化学反应速率
B.合成氨反应中,当3v(NH3)正=2v(H2)逆时,反应达到平衡
C.对于反应PCl5(g) 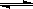 PCl3(g) + Cl2(g),达到平衡后,若保持温度容积不变,又加入一定量的PCl5,则该平衡向正方向移动,但平衡时PCl5的转化率减小
D.将nmol H2(g)、n mol I2(g)和2n mol H2 (g)、2n mol I2(g)分别充入两个等温等容的容
PCl3(g) + Cl2(g),达到平衡后,若保持温度容积不变,又加入一定量的PCl5,则该平衡向正方向移动,但平衡时PCl5的转化率减小
D.将nmol H2(g)、n mol I2(g)和2n mol H2 (g)、2n mol I2(g)分别充入两个等温等容的容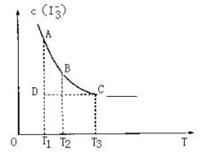 器中,平衡时H2的转化率前者小于后者
器中,平衡时H2的转化率前者小于后者
11.N2(g) + 3H2(g)  2NH3 (g) (正反应放热) ,在某一时间段中反应速率与反应过程的曲线关系如右图。下列说法正确的是
2NH3 (g) (正反应放热) ,在某一时间段中反应速率与反应过程的曲线关系如右图。下列说法正确的是
A.氨气的体积分数最高的一段时间为t5 - t6 B.t2-t3和t3-t4时间段氨气的体积分数相等 C.t1时刻改变的条件是降低温度 D.t4-t5时间段平衡向正反应方向移动
10. 在0.1mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH
在0.1mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH  CH3COO-+H+ 对于该平衡,下列叙述正确的是
A. 加入水时,平衡向逆反应方向移动
B . 加入少量NaOH固体,平衡向正反应方向移动
C . 加入少量0.1mol·L-1 HCl溶液,溶液中c(H+)减小
D . 加入小量CH3COONa固体,平衡向正反应方向移动
CH3COO-+H+ 对于该平衡,下列叙述正确的是
A. 加入水时,平衡向逆反应方向移动
B . 加入少量NaOH固体,平衡向正反应方向移动
C . 加入少量0.1mol·L-1 HCl溶液,溶液中c(H+)减小
D . 加入小量CH3COONa固体,平衡向正反应方向移动
9.下列化学反应中,为使平衡体系析出更多的银,可采取的措施是
Ag++ Fe2+  Ag(固体)+ Fe3+(正反应放热)
A . 常温下加压 B . 增加Fe3+的浓度
C . 增加Fe2+的浓度 D. 移去一些析出的银
Ag(固体)+ Fe3+(正反应放热)
A . 常温下加压 B . 增加Fe3+的浓度
C . 增加Fe2+的浓度 D. 移去一些析出的银
8.下列事实不能用勒夏特列原理解释的是 A.光照氯水,颜色变浅
B.实验室中常用排饱和食盐水的方法收集氯气
C.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
D.压缩H2与I2(g)反应的平衡混合气体,颜色变深
7. 在一密闭烧瓶中,在25℃时存在着平衡:2NO2 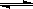 N2O4(正反应放热)。把烧瓶置于100℃的水中,则下列几项性质中不会改变的是
①颜色 ②平均相对分子质量 ③质量 ④压强 ⑤密度
A.③和⑤ B .②和④ C. ④和⑤ D .①和③
N2O4(正反应放热)。把烧瓶置于100℃的水中,则下列几项性质中不会改变的是
①颜色 ②平均相对分子质量 ③质量 ④压强 ⑤密度
A.③和⑤ B .②和④ C. ④和⑤ D .①和③
6.密闭容器中存在化学反应: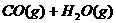
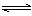
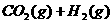 当反应容器中充入1molCO和1mol水蒸气,在一定条件下达到平衡时生成了0.67molCO2,当充入的水蒸气改为4mol,其它条件不变,平衡时生成的CO2的物质的量可能为( )
当反应容器中充入1molCO和1mol水蒸气,在一定条件下达到平衡时生成了0.67molCO2,当充入的水蒸气改为4mol,其它条件不变,平衡时生成的CO2的物质的量可能为( )
A.0.5 mol B.1mol C. 0.95 mol D. 0. 67mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com