
题目列表(包括答案和解析)
5、对反应A+B=AB来说,常温时按以下情况进行反应:①20mL溶液中含A、B各0.01mol;
②50mL溶液中含A、B各0.05mol;③0.1mol•L-1 的A、B溶液各10mL;④0.5moL•L-1 的
A、B溶液各50mL。四者反应速率大小关系是
A、②>①>④>③ B、④>③>②>① C、①>②>④>③ D、①>②>③>④
4、
 下列金属冶炼的反应原理,错误的是
下列金属冶炼的反应原理,错误的是
A、电解法:2NaCl(熔融) 2Na+Cl2↑ B、电解法:2MgO(熔融) Mg+O2↑
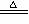 C、热还原法:Fe3O4+4CO 高温==== 3Fe+4CO2 D、热分解法:2HgO 2Hg+ O2↑
C、热还原法:Fe3O4+4CO 高温==== 3Fe+4CO2 D、热分解法:2HgO 2Hg+ O2↑
3、足量的镁粉与一定量的盐酸反应,反应速率太快,为了减慢反应速率,但又不影响产生
氢气的总量,应加入下列物质中的
A、硫酸钠溶液 B、稀硫酸溶液 C、碳酸钠溶液 D、硝酸钠溶液
2、下列说法错误的是
A、旧键的断裂和新键的形成必须通过反应物分子(或离子)的相互接触、碰撞来实现
B、在其它条件不变时,使用催化剂只能改变反应速度,而不能改变化学平衡状态
C、升高温度或加入催化剂,活化分子百分数增加,化学反应速率增大
D、平衡正向移动到达新平衡,生成物的物质的量和浓度比原平衡增大
1、 将少量金属钠投入氯化铝溶液中,下列有关叙述一定正确的是 A、一定有氧气放出 B、一定有沉淀生成 C、一定有金属铝析出 D、一定生成氯化钠
6、 (9分)现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_________热反应,且m+n_________p(填“>”“=”“<”)。
(2)减压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率_________。
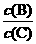
(4)若升高温度,则平衡时B、C的浓度之比 将______ ___,
(5)若加入催化剂,平衡时气体混合物的总物质的量____ _____。
(6) )若降低温度(体积不变),则平衡时混合气体的密度将____ _____。
(7)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色_____ _;
而维持容器内压强不变,充入氖气时,混合物颜色____ ___(填“变深”“变浅”或“不变”)。
5、(12分)依据事实,写出下列反应的热化学方程式。
⑴在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___________________________________________
⑵若适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ热量。____________________________________________________________________
⑶用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量。_________________________________________________________
⑷已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、
946kJ,则N2与H2反应生成NH3的热化学方程式
_________________________________________________________
4、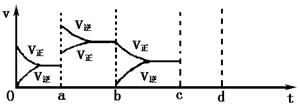 (9分)下图表示在密闭容器中反应:
(9分)下图表示在密闭容器中反应:
2SO2+O2 2SO3△ H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a?b过程中改变的条件可能是
;bc过程中改变的条件可能是
;若增大压强时,反应速度变化情况画在c-d处.
2SO3△ H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a?b过程中改变的条件可能是
;bc过程中改变的条件可能是
;若增大压强时,反应速度变化情况画在c-d处.
3、(6分)在密闭容器中,有可逆反应:nA(气)+mB(气)  pC(气) △ H<0处于平衡状态(已知m+n>p,Q<0)下列说法中正确的是______________ (填序号)
pC(气) △ H<0处于平衡状态(已知m+n>p,Q<0)下列说法中正确的是______________ (填序号)
① 升高温度时,[B]/[C]的值减小;② 降温时,体系内混合气体的平均质量减小;③ 加入B后,A的转化率变大;④ 加入催化剂,气体总物质的量不变;⑤ 充入C后,A,B的物质的量增大.
2、(4分)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)== 2Fe(s)+3CO2(g) △H= ―24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= ―47.2kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
_________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com