
题目列表(包括答案和解析)
5. 碘钨灯比白炽灯使用寿命长。灯管内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:WI2(g) W(s)+I2(g)ΔH>0。下列说法正确的是
W(s)+I2(g)ΔH>0。下列说法正确的是
A.灯管工作时,扩散到灯丝附近高温区的WI2(g)会分解出W重新沉积到灯丝上
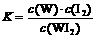 B.灯丝附近温度越高,WI2(g)的转化率越低
B.灯丝附近温度越高,WI2(g)的转化率越低
C.该反应的平衡常数表达式是
D.灯内温度升高时,压强不会变
4.
对于反应2SO2(g)+O2(g) 2SO3(g)能增大正反应速率的措施是
2SO3(g)能增大正反应速率的措施是
A.通入大量O2 B.增大容器容积 C.移去部分SO3 D.降低体系温度
3.
工业制备纯硅的反应:SiCl4(g)+2H2(g) Si(s)+4HCl(g);△H=QkJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器进行以上反应,下列叙述正确的是
Si(s)+4HCl(g);△H=QkJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器进行以上反应,下列叙述正确的是
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
C. 反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min)
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH恰好反应
2. 化学反应中通常伴随着能量变化,下列说法中错误的是 A.煤燃烧时将部分化学能转化为热能 B.电解熔融Al2O3时将部分化学能转化为电能 C.TNT爆炸时将部分化学能转化为动能 D.镁条燃烧时将部分化学能转化为光能
1. 下列反应中生成物总能量高于反应物总能量的是 A.碳酸钙受热分解 B.乙醇燃烧
C.铝粉与氧化铁粉末反应 D.氧化钙溶于水
27.(6分)燃烧 0.10g 酒精( C2H5OH )生成液态水和二氧化碳,放出的热量能使100g水升高温度7.12℃,计算酒精的燃烧热。(水的比热为4.18J/gC,Q=cm△t)
26.(6分)在密闭容器中充入0.02mol·L-1的HI气体,在一定条件下发生反应:2HI(g) H2(g)+I2(g),已知该反应在该温度下的平衡常数K的值约为4。请计算求:(1)达平衡状态时HI的分解率 (2)平衡时H2 的物质的量浓度
H2(g)+I2(g),已知该反应在该温度下的平衡常数K的值约为4。请计算求:(1)达平衡状态时HI的分解率 (2)平衡时H2 的物质的量浓度
25、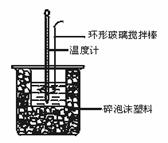 在稀溶液中,酸、碱中和生成1mol水时放出的热量叫中和热。50mL0.50 mol·L-1盐酸和50mL 0.55 mol·L-1烧碱溶液在如图所示的装置中进行中和反应,通过测定反应过程所放出的热量可计算中和热,回答下列问题:
在稀溶液中,酸、碱中和生成1mol水时放出的热量叫中和热。50mL0.50 mol·L-1盐酸和50mL 0.55 mol·L-1烧碱溶液在如图所示的装置中进行中和反应,通过测定反应过程所放出的热量可计算中和热,回答下列问题:
(1)在做中和热实验测定中和热时,下列仪器应选择的是 ( )
①天平 ②量筒 ③烧杯 ④环形玻璃搅拌棒 ⑤温度计 ⑥试管 ⑦酒精灯
A.①②④⑤ B.②③④⑤ C.②③④⑦ D.全部
(2)烧杯间填满碎纸屑的作用是___________________________。 (3)大烧杯若不盖硬纸板,求得的中和热数值将_____________(填“偏大”、“偏小”或“无影响”)。 (4)实验中改用60mL 0.50 mol·L-1的盐酸跟50mL 0.50 mol·L-1的烧碱溶液进行上述反应,与上述实验相比,所放出的热量_________(填“相等”或“不等”),所示的中和热____________,(填“相等”或“不等”)。
24、(12分)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式 。
 (2)PCl5分解成PCl3和Cl2的热化学方程式
,上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80molPCl5,反应达到平衡时PCl5还剩0.60mol,其分解率α1等于_________;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2_______α1(填“大于”、“小于”或“等于”)。
(2)PCl5分解成PCl3和Cl2的热化学方程式
,上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80molPCl5,反应达到平衡时PCl5还剩0.60mol,其分解率α1等于_________;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2_______α1(填“大于”、“小于”或“等于”)。
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是 。
(4)P和Cl2分两步反应生成1molPCl5的△H3= ,P和Cl2一步反应生成1molPCl5的△H4 △H3(填“大于”、“小于”或“等于”)。
23、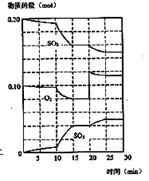 (10分)在一定条件下,二氧化硫和氧气发生反应:
(10分)在一定条件下,二氧化硫和氧气发生反应:
2SO2(g)+ O2 (g) 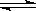 2SO3(g) △H <0;
2SO3(g) △H <0;
(1)该反应的平衡常数表达式K=
(2)升高温度,该反应K值 ,二氧化硫转化率
,化学反应速率
(以上均填增大、减小或不变)
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是
(4)据图判断,反应进行至20min时,曲线开始发生变化的原因是(用文字表达)
(5)10min到15min的曲线变化的原因可能是(填写编号)
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加SO3的物质的量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com