
题目列表(包括答案和解析)
15.
在一密闭容器中进行下列反应:2SO2+O2 2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L,0.1mol/L,0.2mol/L,当达到平衡时,可能存在的是
A.SO2为0.4mol/L,O2为0.2mol/L B.SO2为0.25mol/L
C.SO2,SO3均为0.15mol/L D.SO3为0.4mol/L
2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L,0.1mol/L,0.2mol/L,当达到平衡时,可能存在的是
A.SO2为0.4mol/L,O2为0.2mol/L B.SO2为0.25mol/L
C.SO2,SO3均为0.15mol/L D.SO3为0.4mol/L
14. 在密闭容器中发生下列反应aA(g)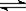 cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A.A的转化率变小 B.平衡向正反应方向移动
C.D的体积分数变大 D.a < c+d
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A.A的转化率变小 B.平衡向正反应方向移动
C.D的体积分数变大 D.a < c+d
13. 金属钾和金属钠的金属性相近,在利用金属钠与KCl共熔制金属钾时,发现钾与钠的共熔体难以分离,如调整温度到一定程度,则可利用钠与KCl反应制取K,下面是四种物质的沸点:据平衡移动原理,可推知用Na与KCl反应制取金属钾的适宜温度是
|
|
K |
Na |
KCl |
NaCl |
|
沸点1℃ |
774 |
882.9 |
1500(升华) |
1413 |
A. 750℃ B.850℃ C. 950℃ D. 1500℃
12.
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g),△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
A.点a的正反应速率比点b的大
2NH3(g),△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
A.点a的正反应速率比点b的大
B.点 c处反应达到平衡 C.点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样 D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大
11.
如图是恒温下某反应的反应速率随时间变化的示意图,下列叙述与示意图不相符合的是
A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡态I后,增大反应物浓度,平衡发生移动,达到平衡态II
C.该反应达到平衡态I后,减小反应物浓度,平衡发生移动,达到平衡态II
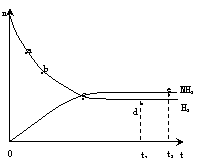 D.同一种反应物在平衡态I和平衡态II时浓度不相等
D.同一种反应物在平衡态I和平衡态II时浓度不相等
10.
常温常压下,甲容器里充有二氧化氮(N2O4 2NO2 △H>0),乙容器里充有空气,现分别进行下列两项实验:(a)将两容器置于沸水中加热 (b)在活塞上都加2 kg的砝码,至容器体积不再变化,在以上两情况下,甲和乙容器的体积大小的比较,正确的是
2NO2 △H>0),乙容器里充有空气,现分别进行下列两项实验:(a)将两容器置于沸水中加热 (b)在活塞上都加2 kg的砝码,至容器体积不再变化,在以上两情况下,甲和乙容器的体积大小的比较,正确的是
A.(a)甲>乙,(b)甲>乙 B.(a)甲>乙,(b)甲=乙
C.(a)甲<乙,(b)甲>乙 D.(a)甲>乙,(b)甲<乙
9.
在一定温度下的定容密闭容器中,当下列物理量不再变化时,能表明反应:
A(s)+2B(g) 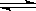 C(g)+D(g)已达平衡的是,
A.混合气体的压强 B.混合气体的密度 C.A的颜色 D.2V(B)正=V(C)逆
C(g)+D(g)已达平衡的是,
A.混合气体的压强 B.混合气体的密度 C.A的颜色 D.2V(B)正=V(C)逆
8. 碰撞理论是一种较直观的反应速率理论,下列有关碰撞理论叙述正确的是 A.增大反应物浓度可以增加活化分子百分数,从而提高有效碰撞几率 B.在一定温度下,同种分子的能量都相同 C.活化分子的碰撞一定就是有效碰撞 D.催化剂可以改变反应的活化能,从而提高有效碰撞几率
7. 用3g块状大理石与30mL3mol/L盐酸反应制取CO2气体,若要增大反应速率且不影响CO2气体的量,可以采用的措施是: ①再加入30mL3mol/L盐酸 ②改用30mL6mol/L盐酸 ③改用3g粉末状大理石 ④适当升高温度
A.①④ B.②③④ C.③④ D.①③④
6.
一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g)
 Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是
Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是
A.以X浓度变化表示的反应速率为0.001 mol/(L·s)
B.将容器体积变为20 L,Z的平衡浓度变为0.015mol/L
C.若增大压强,平衡向正方向移动,平衡常熟变大
D.若升高温度,X的体积分数增大,则该反应的DH>0
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com