
题目列表(包括答案和解析)
3.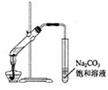 下列有关实验操作的叙述正确的是( )
下列有关实验操作的叙述正确的是( )
A. 实验室常用右图所示的装置制取少量的乙酸乙酯
B. 蒸馏时蒸馏烧瓶中液体的体积不能超过容积的2/3,液体也不能蒸干
C. 将金属钠在研体中研成粉末,使钠与水反应的实验更安全
D. 在苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出
2. 下列有关化学用语使用正确的是( )
A. 硫原子的原子结构示意图: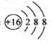 B.NH4Cl的电子式:
B.NH4Cl的电子式: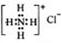
C.Na2O2中氧元素的化合价是-1 D.乙烯的结构简式:CH2CH2
1. 我国稀土资源丰富。下列有关稀土元素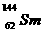 与
与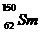 的说法正确的是( )
的说法正确的是( )
A.. 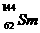 与
与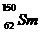 互为同位素 B.
互为同位素 B. 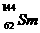 与
与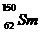 的质量数相同
的质量数相同
C.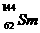 与
与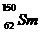 是同一种核素 D.
是同一种核素 D. 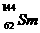 与
与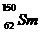 的核外电子数和中子数均为62
的核外电子数和中子数均为62
22. 将0.50 mol SO2(g)和0.30 mol O2(g)放入容积为10 L的密闭容器中,反应2SO2(g)+O2(g) 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
2009-2010学年第一学期高二新课程10月模块专项练习(二)
21. (8分)某同学发现,纯度、质量、表面积都相同的铝片与H+浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝和盐酸反应速率更快
(1)该同学认为:两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO42-对反应没有影响;
原因Ⅱ:_______________________________________________________;
原因Ⅲ:Cl-对反应具有促进作用,而SO42-对反应具有阻碍作用;
原因Ⅳ:Cl-、SO42-均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ:________________________________________________________。
(2)该同学设计并进行了两组实验,即可得出正确结论。他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
a.在盛有硫酸的试管中加入少量NaCl或KCl固体 ,观察反应速率是否变化;
b.在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化。
若观察到实验a中_____________________,实验b中__________________________,则说明原因Ⅲ是正确的。依次类推。
经过实验,他确定原因是Cl-对反应具有促进作用。
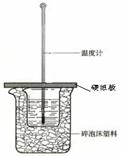
20. (10分)某实验小组设计用50 mL 1.0 mol/L盐酸跟50 mL 1.1 mol/L氢氧化钠溶液在如图所示装置中进行中和反应。试回答下列问题: (1)从实验装置上看,图中尚缺少的一种玻璃仪器是___________ (2)烧杯间填满碎泡沫塑料的作用是 。 (3)大烧杯上如不盖硬纸板,求得的中和热数值____________ 若用醋酸与NaOH溶液反应,则测得的中和热数值_________ 盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热____________(填“偏大”、“偏小”、“无影响”)。 (4)实验中碱液过量的目的是_______________________ (5)实验中若用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 ,所求中和热 (填“相等”、“不相等”) (7)该实验小组做了三次实验,每次取溶液各50 mL,并记录如下原始数据。
|
实验序号 |
起始温度t1/℃ |
终止温度t2/℃ |
温差(t2-t1)/℃ |
|
1 |
25.0 |
31.6 |
|
|
2 |
25.1 |
31.8 |
|
|
3 |
25.1 |
31.9 |
|
已知盐酸、NaOH溶液密度近似为1.00 g/cm3,中和后混合液的比热容C=4.18×10-3 kJ/(g·℃),则该反应的中和热为ΔH=_________________________________。
19. (8分)废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。 (1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 。 A.热裂解形成燃油 B.露天焚烧 C.作为有机复合建筑材料的原料 D.直接填埋 (2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知: Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) △H=64.39kJ·mol-1 2H2O2(l)=2H2O(l)+O2(g) △H=-196.46kJ·mol-1 H2(g)+1/2O2(g)=H2O(l) △H=-285.84kJ·mol-1 在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 。 (3)控制其他条件相同,印刷电路板的金属粉末用10℅H2O2和3.0mol·L-1H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
|
温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
铜平均溶解速率(10-3mol·L-1·min-1) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是________________________________________________________________。
 (4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀。制备CuCl的离子方程式是
。
(4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀。制备CuCl的离子方程式是
。
18.
(10分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g),甲醇的物质的量变化如图2。
(1)反应达到平衡时,平衡常数表达式K=
,升高温度,K值变_______。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
。
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:__________________________________(用化学方程式表示)。
CH3OH(g),甲醇的物质的量变化如图2。
(1)反应达到平衡时,平衡常数表达式K=
,升高温度,K值变_______。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
。
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:__________________________________(用化学方程式表示)。
17.
(8分)反应A(g)+B(g)  C(g) +D(g)过程中的能量变化如图1所示,(E1和E2大于0)回答下列问题。
(1)该反应是____反应(填“吸热”、“放热”),△H=___。
(2)在反应体系中加入正催化剂,E1_______,E2______,△H______,V正______,V逆______,A的转化率______(填“增大”、“减小”或“不变”)。
图1
C(g) +D(g)过程中的能量变化如图1所示,(E1和E2大于0)回答下列问题。
(1)该反应是____反应(填“吸热”、“放热”),△H=___。
(2)在反应体系中加入正催化剂,E1_______,E2______,△H______,V正______,V逆______,A的转化率______(填“增大”、“减小”或“不变”)。
图1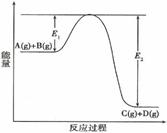 图2
图2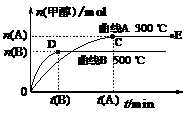
16. 一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20.0%,与反应前的体积相比,反应后体积缩小的百分率是 A.16.7% B.20.0% C.80.0% D.83.3%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com