
题目列表(包括答案和解析)
2.氯化银在水中存在AgCl(s)
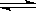 Ag+(aq)+Cl-(aq)溶解平衡,现将足量氯化银分别放入同温下的:①100mL蒸馏水中,②100mL0.1mol·L-1盐酸中,③100mL0.1mol·L-1氯化铝溶液中,④100mL0.1mol·L-1氯化镁溶液中。充分搅拌后,银离子浓度由大到小的顺序是
Ag+(aq)+Cl-(aq)溶解平衡,现将足量氯化银分别放入同温下的:①100mL蒸馏水中,②100mL0.1mol·L-1盐酸中,③100mL0.1mol·L-1氯化铝溶液中,④100mL0.1mol·L-1氯化镁溶液中。充分搅拌后,银离子浓度由大到小的顺序是
 A. ①②③④ B.③④①② C.③④②① D.①②④③
A. ①②③④ B.③④①② C.③④②① D.①②④③
1.已知450℃时,反应H2(g)+I2(g) 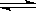 2HI(g)的K=50,由此推测在450℃时,反应
2HI(g)的K=50,由此推测在450℃时,反应
2HI(g)
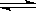 H2(g)+I2(g) 的化学平衡常数为
H2(g)+I2(g) 的化学平衡常数为
A.0.02 B.50 C.100 D.无法确定
21.计算题(8分)
在温度为1273K的密闭容器中发生反应FeO(s)+CO(g)  Fe(s)+CO2(g),此温度时K=0.5 。若起始浓度c(CO)=0.05mol/L c(CO 2)=0.01mol/L,求
Fe(s)+CO2(g),此温度时K=0.5 。若起始浓度c(CO)=0.05mol/L c(CO 2)=0.01mol/L,求
(1)CO 2的平衡浓度 (2)CO的转化率
2009-2010学年度高二第一学期10月质检考试
20.(12分)在2L密闭容器中,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:

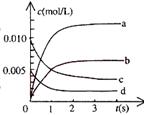 (1)写出该反应的平衡常数表达式:K=___________________。
(1)写出该反应的平衡常数表达式:K=___________________。
已知:K(300℃)>K(350℃),该反应是________反应。(填“吸热”或“放热”)
(2)右图中表示NO2的变化的曲线是____________。
用O2表示从0-2s内该反应的平均速率v=___________。
(3)能说明该反应已经达到平衡状态的是___________。
a、v(NO2)=2v(O2) b、容器内压强保持不变
c、v逆(NO)=2v正(O2) d、容器内的密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a、及时分离出NO2气体 b、适当升高温度
c、增大O2的浓度 d、选择高效的催化剂
e、通入氮气使反应体系压强
19.(12分)
反应A(g)+B(g) C(g)
+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)
+D(g)过程中的能量变化如图所示,回答下列问题。
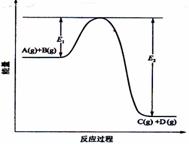
(1)该反应的△H 0(填“大于”“小于”)
(2)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1 ,E2 (填“增大”“减小、”“不变”)。对反应热是否有影响?
原因是
(3)改变下列条件,能使反应体系内活化分子百分数改变的是
①减小反应物浓度 ②减小压强 ③降低温度 ④加入催化剂
⑤增大反应物浓度 ⑥升高温度
18.(12分)我国目前发射火箭主要采用强氧化剂H2O2和强还原剂液态肼N2H4作燃料。它们混合反应时,产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出256.652kJ的热量。请回答。
(1)反应的热化学方程式为: 。
(2)又已知H2O(液)=H2O(气);△H=44kJ·mol-1 ,写出液态肼与足量液态双氧水反应,生成2moL氮气和液态水的热化学方程式 .
(3)计算16g液态肼与足量液态双氧水参加上述反应生成液态水时放出的热量
为: kJ。
(4)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是: 。
17.(8分)海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。
(1)在光照条件下,氯气和氢气反应过程如下:
①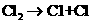 ②
②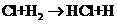 ③
③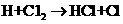 ……
……
反应②中形成的化合物的电子式为 ;反应③中被破坏的化学键属
于 键(填“极性”或“非极性”)。
(2)在短周期主族元素中,氯元素及与其相邻元素的原子半径从大到小的顺序是
(用元素符号表示)。与氯元素同周期且金属性最强的元素位于周期表的第 周期
族。
(3)卤素单质及化合物在许多性质上都存在着递变规律。下列有关说法正确的是 。
a.卤化氢的稳定性按HF、HCl、HBr、HI 的顺序依次减弱
b.卤化氢的沸点按HF、HCl、HBr、HI 的顺序依次增大
c.卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
d.卤素单质与氢气化合按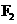 、
、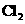 、
、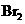 、
、 的顺序由难变易
的顺序由难变易
16. 已知:H2(g)+I2(g)
 2HI(g) ΔH<0。 有相同容积的定容密封容器甲和乙,甲中加入
2HI(g) ΔH<0。 有相同容积的定容密封容器甲和乙,甲中加入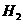 和
和 各0.1mol ,乙中加入HI
0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
各0.1mol ,乙中加入HI
0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
A.甲、乙提高相同温度 B 甲中加入0.1mol He,乙不改变
C.甲降低温度,乙不变 D 甲增加0.1mol 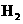 ,乙增加0.1mol I2
,乙增加0.1mol I2
第Ⅱ卷 非选择题
15. 实验中不能直接测出石墨和氢气生成甲烷反应的反应热,但可测出甲烷
石墨、氢气燃烧的反应热:
(l)
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1=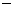 890.3kJ/mol
890.3kJ/mol
(2) C(s石墨)+ O2(g)= CO2(g) △H2=
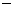 393.5kJ/mol
393.5kJ/mol
(3)
H2(g)+1/2O2(g)=H2O(l) △H3=
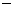 285.8KJ/moL ,
285.8KJ/moL ,
由此可知反应C(s石墨)+ 2H2(g)= CH4(g) 的 ΔH为( )
A. + 74.8 kJ/mol B. +211 kJ/mol
C. 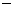 1569.6 kJ/mol
D.
1569.6 kJ/mol
D. 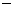 74.8 kJ/mol
74.8 kJ/mol
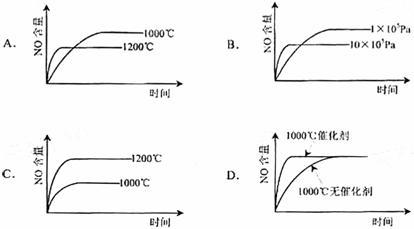
14.已知:4NH3(g)+5O2(g)=4NO(g)+6H2(g). △H=-1025kJ/mol,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com