
题目列表(包括答案和解析)
1. 未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源的是①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
( )
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源的是①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
( )
A.①②③④ B.⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
21.(16分)美国阿波罗宇宙飞船上使用的氢氧燃料电池
 是一种新型的化学电池,其构造如图所示;两个电极
是一种新型的化学电池,其构造如图所示;两个电极
均由多孔性碳制成,通入的气体由孔隙中逸出,并在
电极表面放电。
(1)a极是 极,b极是 极,电极
反应式分别为 ,
。
(2)飞船上宇航员的生活用水由燃料电池提供。已知这种电池发1度电时能生成350g水,试计算能量转化率 。
 [2H2(g)+O2(g) 2H2O(l)+572kJ]
[2H2(g)+O2(g) 2H2O(l)+572kJ]
(3)这种电池的输出电压为1.2V。要使标有1.2V,1.5W的小灯泡连续发光0.5h,应消耗标准状况下H2的体积为 升?
(4)氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制。常用的燃料,往往是某些碳氢化合物,如甲烷(天然气)、汽油等。请写出将图中H2换成CH4时所构成的甲烷燃料电池中a极的电极反应式: 。
此时电池内总的反应方程式为 。
座号:
20. (12分)恒温下,将amolN2和bmolH2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2 +3H2 2NH3
(12分)恒温下,将amolN2和bmolH2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2 +3H2 2NH3
⑴若反应在达平衡前的某时刻,t时,nt(N2)=13mol nt(NH3)=6mol, a 。
⑵反应达平衡时,混合气体的体积为726.8L(标准状况)其中NH3的含量(体积分数)为25%。平衡时NH3的物质的量为 。
⑶原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同)
n始:n平=
⑷原混合气体中a:b=
⑸达到平衡时,N2和H2的转化率之比为
⑹平衡混合气体中nN2: nH2 :n(NH3)=
19.(6分)从H+、Cu2+、Na+、SO42-、Cl-五种离子中恰当地组成电解质,按下列要求进行电解:
(1)以碳棒为电极,使电解质质量减少,水质量不变,进行电解,则可采用的电解质是 。
(2)以碳棒为电极,使电解质质量不变,水质量减少,进行电解,则可采用的电解质是 。
(3)以碳棒为阳极,铁棒为阴极,使电解质和水质量都减少,进行电解,则电解质为 。
18.(10分)将等物质的量的A、B、C、D四种物质混合,发生如下反应,
 aA+bB cC(s)+dD。当反应进一定时间后测得A减少了n mol,B减少了n/2mol,C增加了3n/2mol,D增加了n mol,此时达到化学平衡。
aA+bB cC(s)+dD。当反应进一定时间后测得A减少了n mol,B减少了n/2mol,C增加了3n/2mol,D增加了n mol,此时达到化学平衡。
该化学方程式个物质的系数为a b c d 。
若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中物质聚集状态:
A. B D 。
若只升高温度,反应一段时间后,测知四种物质的量又达到相等,测该反应为 反应 (填“放热”或“吸热”)
17.(8分)红磷(P)和白磷(P4)均为磷的同素异形体。已知:
①两者在氯气中燃烧,均有白烟雾产生;
②P4(s)+5O2=P4O10(s);△H1=-2983.2kJ/mol
P(s)+5/4O2=1/4P4O10(s);△H1=-738.5kJ/mol
(1)写出红磷在氯气中燃烧的化学方程式
,
(2)写出白磷转化为红磷的热化学方程式 ,
由此可知,红磷比白磷 (填“稳定”或“不稳定”)。
16. 一定条件下,在2SO2+O2 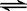 2SO3的化学平衡体系中,各物质的浓度分别是2.0mol/L、0.8mol/L、2.4mol/L则氧气在起始的浓度可能是
( )
2SO3的化学平衡体系中,各物质的浓度分别是2.0mol/L、0.8mol/L、2.4mol/L则氧气在起始的浓度可能是
( )
(A) 0.8-2 mol/L (B)0-2 mol/L (C)0-0.8mol/L (D)无法确定
第Ⅱ卷(非选择题 共52分)
15. 在2L的密闭容器中,发生以下反应:2A(气)+B(气) 2C(气)+D(气)若最初加入的A和B都是4
mol,在前10s A的平均反应速度为0.12 mol/(L·s),则10s时,容器中B的物质的量是( )
2C(气)+D(气)若最初加入的A和B都是4
mol,在前10s A的平均反应速度为0.12 mol/(L·s),则10s时,容器中B的物质的量是( )
A 3.6 mol B 2.8 mol C 2.4 mol D 1.2 mol
14. 在一处于平衡状态的反应:X(g) + 3B(g)  2Z(g) △H<0
,为了使平衡向生成Z的方向移动,应选择下列的适宜条件是( )
2Z(g) △H<0
,为了使平衡向生成Z的方向移动,应选择下列的适宜条件是( )
①高温 ②低温 ③高压 ④低压 ⑤加正催化剂 ⑥除去Z
A.①③⑤ B.②③⑤ C. ②③⑤⑥ D.②③⑥
13. 一氧化氮与一氧化碳都是汽车尾气里的有害物质,它们能缓慢地起反应生成氮气和二氧化碳。对此反应,下列叙述中正确的是( )
A 使用催化剂能改变平衡常数 B 使用催化剂能改变反应速率
C 改变压强对反应速率没有影响 D 降低压强能加大反应速率
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com