
题目列表(包括答案和解析)
13.硫代硫酸钠溶液与稀硫酸反应的化学方程式为Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是 ( )
|
实验 |
反应温度/℃ |
Na2S2O3溶液 |
稀H2SO4 |
H2O |
||
|
V/mL |
c/(mol·L-1) |
V/mL |
c/(mol·L-1) |
V/mL |
||
|
A |
25 |
5 |
0.1 |
10 |
0.1 |
5 |
|
B |
25 |
5 |
0.2 |
5 |
0.2 |
10 |
|
C |
35 |
5 |
0.1 |
10 |
0.1 |
5 |
|
D |
35 |
5 |
0.2 |
5 |
0.2 |
10 |
12.25 ℃时,水的电离达到平衡:H2O  H+ + OH- ,下列叙述正确的是( )
H+ + OH- ,下列叙述正确的是( )
A.向水中加入少量固体NaCl,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大
C.将水加热,Kw增大,pH不变
D.向水中加入少量固体NaOH ,平衡逆向移动,c(H+)降低
11.取浓度相同的NaOH 和HCl溶液,以3:2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为( )
A.0.01mol·L-1 B.0.017mol·L-1 C.0.05mol·L-1 D.0.50mol·L-1
10.下列说法正确的是( )
A.常温下,向pH为1的硝酸溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和
B.Al3+、NO3-、Cl-、CO32-、Na+可以大量共存于pH=2的溶液中
C.乙醇和乙酸都能溶于水,都是电解质
D. 分别与等物质的量的HCl和H2SO4反应时,消耗NaOH的物质的量相同
9.已知:4NH4(g)+5O2(g) = 4NO(g)+6H2O(g) ΔH=-1025kJ·mol-1,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )






8.已知:(1)Zn(s)+1/2O2(g)==ZnO(s) ΔH=-348.3kJ/mol
(2) 2Ag(s)+1/2 O2(g)== Ag2O(s) ΔH=-31.0kJ/mol
则Zn(s)+ Ag2O(s)== ZnO(s)+ 2Ag(s)的ΔH等于( )
A.-317.3kJ/mol B.-379.3kJ/mol
C.-332.8 kJ/mol D.317.3 kJ/mol
7.将0.1 mol·L-1的CH3COOH溶液稀释10倍,下列微粒浓度减小得最多的是( )
A.CH3COO- B. OH- C.H+ D.CH3COOH
6.下列热化学方程式书写正确的是( 的绝对值均正确)( )
的绝对值均正确)( )
A.C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g)△H= -1367.0 kJ/mol(燃烧热)
B. NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)△H= +57.3kJ/mol(中和热)
C.S(s)+O2(g)===SO2(g) △H= -269.8kJ/mol(反应热)
D. 2NO2==O2+2NO △H= +116.2kJ/mol(反应热)
5.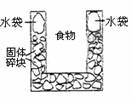 右图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎块混和,杯内食物温度逐渐上升。制造此加热杯可选用的固体碎块是( )
右图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎块混和,杯内食物温度逐渐上升。制造此加热杯可选用的固体碎块是( )
A.硝酸铵 B.食盐 C.氯化镁 D.生石灰
4.有关碰撞理论,下列说法中正确的是( )
A.具有足够能量的分子(活化分子)相互碰撞就一定能发生化学反应
B.增大反应物浓度,可增大活化分子的百分数,从而使有效碰撞次数增大
C.升温能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能,从而只影响反应速率不影响化学平衡
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com