
题目列表(包括答案和解析)
12.将等质量的a、b两份锌粉装入试管中,分别加入过量的稀硫酸,同时向装a的试管中加入少量CuSO4溶液。下图表示产生氢气的体积V与时间t的关系,其中正确的是( )

11.按A图装置进行实验,若图B的X轴表示流入电极的电子的量,则Y轴不可能表示的情况是( )

A B
A、 B、
B、 C、溶液的C(H+) D、银棒质量
C、溶液的C(H+) D、银棒质量
10.已知 (1)H2(g)+1/2O2(g)=H2O(g) △H1=a kJ/mol
(2)2H2(g)+O2(g)=2H2O(g) △H2=b kJ/mol
(3)H2(g)+1/2O2(g)=H2O(l) △H3=c kJ/mol
(4)2H2(g)+O2(g)=2H2O(l) △H4=d kJ/mol
下列关系式中正确的是 ( )
A、a<c<0 B、b>d>0 C、2a=b<0 D、2c=d>0
9.X、Y、Z、M代表四种金属元素。金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若电解Y2+和Z2+离子共存的溶液时,Y先析出;又知M2+离子的氧化性强于Y2+离子。则四种金属的活动性由强到弱的顺序为( )
A.X>Z>Y>M B.X>Y>Z>M C.M>Z>X>Y D.X>Z>M>Y
8.下列说法或表示方法中正确的是( )
A、等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B、由C(金刚石)→C(石墨)ΔH= -1.9KJ/mol 可知,金刚石比石墨稳定
C、在101KPa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH=+285.8KJ/mol
D、稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH= -53.7KJ/mol ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于53.7KJ
7. 在A、B、C三只烧杯中各盛放稀硫酸、氯化钠溶液和硝酸银溶液各1000
在A、B、C三只烧杯中各盛放稀硫酸、氯化钠溶液和硝酸银溶液各1000 。根据下图判断下列说法中正确的是(假设溶液的体积变化忽略不计,两极产物不发生反应)( )
。根据下图判断下列说法中正确的是(假设溶液的体积变化忽略不计,两极产物不发生反应)( )
A.A池为电解装置 B.A池锌棒电极反应为 →
→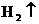
C.B池石墨1上的电极反应为 →
→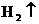
D.当A池产生0.05mol 时,C池铜棒上析出10.8克银
时,C池铜棒上析出10.8克银
6.钢铁生锈过程发生如下反应:
①2Fe+O2+2H2O=2Fe(OH)2;②4Fe(OH)2+O2+2H2O=4Fe(OH)3;③2Fe(OH)3=Fe2O3+3H2O。
下列说法正确的是( )
A.反应①、②中电子转移数目相等
B.反应①中氧化剂是氧气和水
C.与铜质水龙头连接处的钢质水管不易发生腐蚀
D.钢铁在潮湿的空气中不能发生电化学腐蚀
5.下列各图所表示的反应是吸热反应的是 ( )

A B C D
4.把分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为 ( )
A、1︰2︰3 B、3︰2︰1 C、6︰3︰1 D、6︰3︰2
3.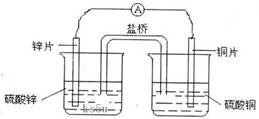 关于右图所示的原电池,下列说法正确的是( )
关于右图所示的原电池,下列说法正确的是( )
A.电子从锌电极通过检流计流向铜电极
B.盐桥中的阴离子向硫酸铜溶液中迁移
C.锌电极发生还原反应,铜电极发生氧化反应
D.铜电极上发生的电极反应是2H++e-→H2↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com