
题目列表(包括答案和解析)
15.在密闭容器中进行如下反应:X2(g)+Y2(g)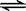 2Z(g),已知X、Y、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
2Z(g),已知X、Y、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
A.Z为0.3mol/L B.Y2为0.4mol/L
C.X2为0.2mol/L D.Z为0.4mol/L
14.NO和CO都是汽车尾气中的物质,它们能很缓慢地反应生成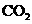 和
和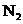 ,对此反应有关的叙述中不正确的是
,对此反应有关的叙述中不正确的是
A.升高温度能加快化学反应速率;
B.使用适当催化剂可以加快化学反应速率;
C.增大一氧化氮的量可以加快化学反应速率;
D.改变压强对化学反应速率没有影响。
13. 在2A+B=3C+4D反应中,表示该反应速率最快的是
A. B.
B.
C. D.
D.
12.一定条件下反应N2(g)+3H2(g)
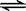 2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内N2的反应速率为
(
)
2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内N2的反应速率为
(
)
 A.1.2mol/(L·min)
B.1mol/(L·min)
A.1.2mol/(L·min)
B.1mol/(L·min)
C.0.6mol/(L·min) D.0.4mol/(L·min)
11.2003年10月15日我国成功发射了第一艘载人航天飞船--“神州五号”。从此我国进入了航天大国和航天强国行列。发射“神五”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。已知:N2(g) + 2O2(g) = 2NO2(g);△H = + 67.7kJ/mol。 N2H4(g) + O2(g) = N2(g) + 2H2O(g);△H = – 534kJ/mol。
下列关于肼和NO2反应的热化学方程式中,正确的是 ( )
A.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(l);△H = – 1135.7kJ/mol
B.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = – 1000.3kJ/mol
C.N2H4(g) + NO2(g) = 3/2N2(g) + 2H2O(l);△H = – 1135.7kJ/mol
D.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = – 1135.7kJ/mol。
10.已知反应:① ;②稀溶液中,
;②稀溶液中, ,下列结论正确的是:
,下列结论正确的是:
A.碳的燃烧热大于110.5kJ/mol
B.①的反应热为221kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为△H=57.3kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3kJ热量
9.下列热化学方程式中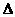 H代表燃烧热的是
H代表燃烧热的是
 A.
A.
B.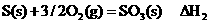
C.
D.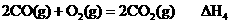
8.同温同压下,已知下列各反应为放热反应,下列各热化学方程式中最小 的是
的是
A. B.
B.
C. D.
D.
7.25℃,101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是
A.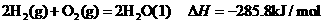
B.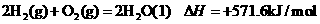
C.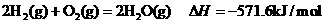
D.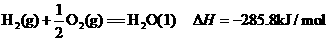
6.下列反应中生成物总能量高于反应物总能量的是
A.碳酸钙受热分解 B.乙醇燃烧
C.铝粉与氧化铁粉末反应 D.氧化钙溶于水
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com