
题目列表(包括答案和解析)
17.(各2分,共12分)在下列物质中:①NaOH、②H2O2、
③(NH4)2S、④Na2O2、⑤C2H2、⑥SiC晶体 ⑦Na2S ⑧单晶硅。
⑴ 其中含有极性共价键的原子晶体是 ;
⑵ 其中只含有离子键的离子晶体是 ;
⑶ 其中既含有离子键又含有非极性共价键的离子晶体是 ;
⑷ 其中既含有离子键,又含有极性共价键和配位键的离子晶体是 ;
⑸其中含有极性共价键和非极性共价键的非极性分子是 ;
⑹其中含有极性共价键和非极性共价键的极性分子是 。
16. 已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
A.X与Y形成化合物,X可以显负价,Y显正价
B.第一电离能可能Y小于X
C.气态氢化物的稳定性:HmY小于HnX
D. 最高价含氧酸的酸性:X对应的酸性弱于于Y对应的
第Ⅱ卷(非选择题 共52分)
15、下列分子或离子中键角由大到小排列顺序是( )
①BF3 ②NH3 ③H2O ④NH4+ ⑤BeCl2
A.⑤④①②③ B.⑤①④②③ C.④①②⑤③ D.③②④①⑤
14、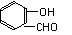
 氢键既可以存在于分子之间,也可以存在于分子内部的原子团之间,如邻羟基苯甲醛分子(
) 内的羟基与醛基之间即存在氢键(分子内氢键),对羟基苯甲醛分子( HO
CHO )之间存在氢键(分子间氢键)。则两者的熔点、沸点的相对大小关系是( )
氢键既可以存在于分子之间,也可以存在于分子内部的原子团之间,如邻羟基苯甲醛分子(
) 内的羟基与醛基之间即存在氢键(分子内氢键),对羟基苯甲醛分子( HO
CHO )之间存在氢键(分子间氢键)。则两者的熔点、沸点的相对大小关系是( )
A、前者>后者 B、前者<后者 C、前者=后者 D、无法估计
13、用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是( )
A.直线形;三角锥形 B. V形;三角锥形
C.直线形;平面三角形 D. V形;平面三角形
12.根据等电子原理,等电子体之间结构相似、物理性质也相近。以下各组粒子不能互称为等电子体的是( )
A.CO和N2 B.O3和SO2 C.CO2和N2O D.N2H4 和C2H4
11.下列配合物的水溶液中加入硝酸银不能生成沉淀的是( )
A.[Co(NH3)4 Cl2] Cl B.[Co(NH3)3 Cl3]
C.[Co(NH3)6] Cl3 D.[Cu(NH3)4]Cl2
10.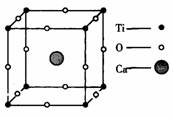 某物质的晶体中含Ti、O、Ca三种元素,其晶胞排列方式如右图所示,晶体中Ti、O、Ca的中原子个数之比为( )
某物质的晶体中含Ti、O、Ca三种元素,其晶胞排列方式如右图所示,晶体中Ti、O、Ca的中原子个数之比为( )
A.1:3:1 B.2:3:1
C.2:2:1 D.1:3:3
9、下列各组分子中,都属于含有极性键的非极性分子的一组是( )
A.CO2、H2O B.C2H4、CH4 C.Cl2、C2H2 D.NH3、HCl
8.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液,下列对此现象的说法正确的是( )
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B. 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4] 2+
C. [Cu(NH3)4] 2+的空间构型为正四面体型
D. 在[Cu(NH3)4] 2+离子中,Cu2+给出孤对电子,NH3提供空轨道
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com