
题目列表(包括答案和解析)
15.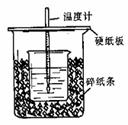 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
14.指出下列变化能量是怎样转化的:
(1)学校燃烧煤煮饭 ,
(2)给手机的电池充电 ,
(3)用畜电池点亮灯泡 ,
(4)电解水得到O2和H2
13.从能量的角度看,断开化学键要 ,形成化学键要 。化学反应时释放能量还是吸收能量要取决于 ,当反应物的总能量高于生成物时,该反应为 反应;当反应物的总能量低于生成物时,该反应为 反应。
12、工业生产硫酸过程中SO2在接触室中被氧化为SO3,已知该反应为放热反应,现将2molSO2与1molO2充入一密闭容器中充分反应后,放出热量98.3kJ,此时测得SO2转化率为50%则下列热化学方程式正确的是








A 2SO2(g) + O2(g)  2SO3(g);
2SO3(g); 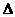 H=-196.6kJ/mol
H=-196.6kJ/mol
B 2SO2(g) + O2(g)  2SO3(g);
2SO3(g); 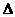 H=-98.3kJ/mol
H=-98.3kJ/mol
C SO2(g) + 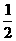 O2(g)
O2(g)  SO3(g);
SO3(g); 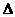 H=+98.3kJ/mol
H=+98.3kJ/mol
D SO2(g) + 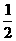 O2(g)
O2(g)  SO3(g);
SO3(g); 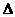 H=-196.6kJ/mol
H=-196.6kJ/mol
Ⅱ卷(非选择题)
11、下列各图中表示热化学方程式A(g)+B(g) =C(g)+D(l) ;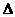 H<0的是(E表示能量)
H<0的是(E表示能量)

A B C D
10、已知16g硫变成硫蒸汽需要吸收akJ的热量,而44.8L(已换算为标准状况),硫蒸汽完全燃烧会放出bkJ的热量,则下列热化学方程式正确的是
A S(s) + O2(g) =SO2(g); 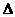 H=-
H=- kJ/mol B S(g) + O2(g)
=SO2(g);
kJ/mol B S(g) + O2(g)
=SO2(g); 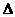 H=
H=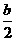 kJ/mol
kJ/mol
C S(s) + O2(g) =SO2(g); 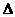 H=(2a+
H=(2a+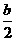 )kJ/mol D S(s) + O2(g) =SO2(g);
)kJ/mol D S(s) + O2(g) =SO2(g); 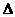 H=-(b-a)kJ/mol
H=-(b-a)kJ/mol
9、已知下列两个化学方程式:
2H2(g)+ O2(g) =2H2O(l);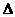 H=-571.6kJ/mol
H=-571.6kJ/mol
CH4(g)+2O2(g) =CO2(g)+2H2O(l);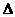 H=-890.3kJ/mol
H=-890.3kJ/mol
今有氢气、甲烷组成的混合气体134.4L(标准状况)完全燃烧生成液态水和二氧化碳共放出4435kJ的热量,则混合气体中氢气与甲烷的体积比为
A 1:2 B 1:3 C 3:1 D 4:1
8、充分燃烧一定量丁烷气体时放出的热量为xQ,完全吸收它生成的CO2转化成正盐,需5mol/l的KOH溶液100ml,则丁烷的燃烧热为








A 16xQ B 8xQ C 4xQ D 2xQ
7、已知2H2(g)+ O2(g) =2H2O(l);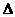 H1=-571.6kJ/mol则关于热化学方程式2H2O(l) = 2H2(g)+ O2(g)
H1=-571.6kJ/mol则关于热化学方程式2H2O(l) = 2H2(g)+ O2(g) 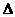 H2的说法中正确的是
H2的说法中正确的是
A 方程式中计量数表示分子数 B 该反应的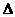 H2肯定大于零
H2肯定大于零
C 该反应的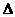 H2=-571.6kJ/mol D 该反应的
H2=-571.6kJ/mol D 该反应的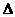 H2=-285.8kJ/mol
H2=-285.8kJ/mol
6、假设一头小猪40kg,体内储存脂肪的能量为30000kJ,如果快速奔跑1km要消耗400kJ能量,那么此小猪的脂肪理论上可维持快速奔跑的距离是
A 12km B 16km C 75km D 150km
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com