
题目列表(包括答案和解析)
16.某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
根据以上规律判断,下列结论正确的是
A.反应Ⅰ:△H>0,P2>P1
B.反应Ⅱ:△H<0,T1>T2
C.反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1
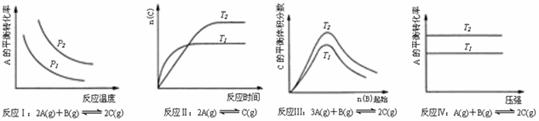 D.反应Ⅳ:△H<0,T2>T1
D.反应Ⅳ:△H<0,T2>T1
15.在密闭容器中进行如下反应: X2(g) + Y2(g)  2Z(g), 已知 X2、Y2、Z的起始浓度分别为 0.1 mol/L、0.3 mol/L、 0.2 mol/L, 在一定的条件下, 当反应达到平衡时, 各物质的浓度有可能是
2Z(g), 已知 X2、Y2、Z的起始浓度分别为 0.1 mol/L、0.3 mol/L、 0.2 mol/L, 在一定的条件下, 当反应达到平衡时, 各物质的浓度有可能是
A.Z为0.3 mol/L B. Y2 为0.35 mol/L C.X2 为0.2 mol/L D.Z为 0.4 mol/L
14.恒温条件下,将NO2装入带活塞的密闭容器中,当反应2NO2(g) N2O4(g)达到平衡后慢慢压缩气体体积,下列叙述正确的是
N2O4(g)达到平衡后慢慢压缩气体体积,下列叙述正确的是
A.若气体体积减小一半,则压强为原来的两倍
B.平衡向右移动,混合气体颜色一定会变浅
C.若气体体积减小一半,压强增大,但小于原来的两倍
D.平衡向右移动,混合气体密度减小
13.已知两个热化学方程式:
C(s)+O2(g) = CO2(g) △H=-393.5kJ/mol
2H2(g)+O2(g) = 2H2O(g) △H=-483.6kJ/mol
现有炭粉和H2组成的悬浮气共0.2mol,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是
A.2︰3 B.1︰2 C. 1︰1 D.3︰2
12.在两个恒容容器中有平衡体系:2A(g) +B(g)
 2C(g)和2D(g)
2C(g)和2D(g)  E(g),X1和X2分别是A和D的转化率。在温度不变情况下,均增加相同的B和D的物质的量,下列判断正确的是
E(g),X1和X2分别是A和D的转化率。在温度不变情况下,均增加相同的B和D的物质的量,下列判断正确的是
A.X1减小,X2增大 B.X1、X2均减小
C.X1增大,X2减小 D.X1、X2均增大
11.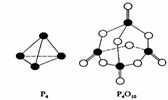 白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P a kJ/mol、 P-O b kJ/mol、P=O c kJ/mol、O=O d kJ/mol。根
白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P a kJ/mol、 P-O b kJ/mol、P=O c kJ/mol、O=O d kJ/mol。根
据图示的分子结构和有关数据估算该反应的△H,其中正确的是
A.(4a+5d-4c-12b)kJ·mol-1
B.(4c+12b-6a-5d)kJ·mol-1
C.(4c+12b-4a-5d)kJ·mol-1
D.(6a+5d-4c-12b)kJ·mol-1
10.一定温度下,向一个事先装有催化剂的2L的真空密闭容器中通入1molN2和3mol H2,3min后测得密闭容器内的压强是起始时的0.9倍,在此时间内v(H2)是
A.0.2mol/(L·min) B.0.6 mol/(L·min)
C.0.3 mol/(L·min) D.0.1 mol/(L·min)
9.对于反应2A(g)+B2(g)  2AB(g) 温度每升高100C,反应速率为原来的2倍。若100C时A的反应速率为amol·L-1·s-1
,则400C时B2的反应速率为
2AB(g) 温度每升高100C,反应速率为原来的2倍。若100C时A的反应速率为amol·L-1·s-1
,则400C时B2的反应速率为
A.3 amol·L-1·s-1 B.6 amol·L-1·s-1 C.4 amol·L-1·s-1 D.8 amol·L-1·s-1
8.在一定温度下,反应2SO2+O2
 2SO3达到平衡时,n(SO2):n(O2):n(SO3)=2:3:4,缩小体积,反应再次达到平衡。n(O2)=0.8mol,n(SO3)=1.4mol,此时SO2的物质的量为
2SO3达到平衡时,n(SO2):n(O2):n(SO3)=2:3:4,缩小体积,反应再次达到平衡。n(O2)=0.8mol,n(SO3)=1.4mol,此时SO2的物质的量为
A.0.6mol B.0.4mol C.0.8mol D.1.2mol
7.已知298K时2SO2( g ) + O2( g )  2SO3(
g ) △H = -197 kJ /mol,在相同温度下向一密闭恒压容器中加入2 mol SO2和1 molO2 ,达化学平衡时放出热量为a1 kJ ;向另一起始容积相同的密闭恒容容器中通入 1 mol SO2和0.5 molO2 ,达化学平衡时放出热量为a2 kJ ,则下列关系式中正确的是
2SO3(
g ) △H = -197 kJ /mol,在相同温度下向一密闭恒压容器中加入2 mol SO2和1 molO2 ,达化学平衡时放出热量为a1 kJ ;向另一起始容积相同的密闭恒容容器中通入 1 mol SO2和0.5 molO2 ,达化学平衡时放出热量为a2 kJ ,则下列关系式中正确的是
A.2a2 <a1< 197 B.2a2 >a1 >197
C.2a2 = a1 >197 D.2a2 = a1 = 197
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com