
题目列表(包括答案和解析)
5.一定温度下,对可逆反应N2(g) + 3H2(g) 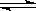 2NH3(g)
的下列叙述中,能说明反应已达到平衡的是( )
2NH3(g)
的下列叙述中,能说明反应已达到平衡的是( )
A、体系的压强不再改变 B.混合气体的质量不再变化
C.单位时间内消耗a mol N2,同时生成2a mol NH3
D.反应消耗的 、与产生的的速率υ() : υ() : υ()== 1∶3 ∶2
4、 目前人们能够直接利用的主要能源是( )
A、煤、石油、天然气 B、太阳能 C、氢能 D、原子能、核能
3、对于反应:4NH3(g) + 5O2(g) = 4NO(g) + 6H2O(g), 下列为四种不同情况下测得的反应速率,其中能表明该反应进行最快的是( )
A.v(NH3)= 0.2mol·L-1·s-1 B.v(O2 )= 0.24 mol·L-1·s-1
C.v(H2O )= 0.25 mol·L-1·s-1 D.v(NO) = 0.15 mol·L-1·s-1[来
2、下列反应中反应物总能量高于生成物总能量的是( )
A.氢气还原三氧化钨 B.高锰酸钾分解
C.锌放入稀硫酸中 D.碳和水蒸气在高温下反应
1、下列物质既可以做防腐剂,又可以做调味剂的是 ( )
A.味精 B.食盐 C.苯甲酸钠 D.柠檬黄
21(4分)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列的反应(由氨气、HCl和水制备NH4C1水溶液),推断反应④的反应热为________ kJ/mol。
① NH3(g)+HCl(g)=NH4Cl(s) △H=-176kJ/mol
② NH3(g) = NH3(aq) △H=-35.1kJ/mol
③ HCl(g) = HCl(aq) △H=-72.3kJ/mol
④ NH4C1(s) = NH4C1(aq)
⑤ NH3(aq)+HCl(aq)=NH4C1(aq) △H=-52.3kJ/mol
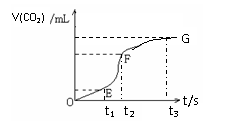
22(9分)用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
(1)实验过程如下图所示,分析判断:________段化学反应速率最快,_______时刻收集的二氧化碳气体最多。(用t表示的时间填写)
(2)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是
 A.蒸馏水
A.蒸馏水
B.少量氯化钠固体
C.氯化钠溶液
D.浓盐酸
E.少量CH3COONa固体
23(7分)将等物质的量的A、B混合于容积为2L的密闭容器中,发生如下反应:
 3A(g)+B(g)
3A(g)+B(g)  xC(g)+2D(g)经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(L·min)。
xC(g)+2D(g)经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(L·min)。
试求: (1)此时A的浓度及反应开始前容器中A、B的物质的量。
(2)B的平均反应速率。
(3)x的值。
24(10分)已知1 molCO气体完全燃烧生成CO2 气体放出283 kJ热量;1 mol氢气完全燃烧生成液态水放出286 kJ热量;1 molCH4气体完全燃烧生成CO2气体和液态水放出890 kJ热量。
(1)写出氢气燃烧的热化学方程式 。
(2) molCH4气体完全燃烧生成CO2气体和水蒸气,放出热量为 890 kJ( 填“>”、 “<”、“= ”)。
(3)若将a molCH4、CO和H2的混合气体完全燃烧,生成 CO2气体和液态水时,则放出热量Q的取值范围是 。
(4)若将a molCH4、CO和H2的混合气体完全燃烧,生成 CO2气体和液态水,且CO2和水的物质的量相等时,则放出热量Q的的取值范围是: 。
25(10分)在密闭容器中,将1.0mol
A与1.0mol
B混合加热到800℃,发生下列反应:A(g)+B(g) C(g)+D(g)一段时间后该反应达到平衡,测得A的物质的量为0.5mol。回答下列问题:
C(g)+D(g)一段时间后该反应达到平衡,测得A的物质的量为0.5mol。回答下列问题:
(1)平衡时A的转化率为 ,该反应的化学平衡常数为 。
(2)如果保持温度不变继续向该平衡体系中通入1.0mol的B(g),相同条件下反应达到新的平衡状态,则A的转化率将 (填“增大”、“减小”、“不变”),A的转化率为 。
(3)427℃时该反应的平衡常数为9.4,请结合(1)中的计算结果判断该反应的△H 0(填“>”、“=”或“<”)。
哈 师 大 附 中 高 二 学 年 月 考 2009、10
化 学 试 卷 答 题 纸
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
|
|
|
|
|
|
|
|
|
|
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
|
|
|
|
|
|
|
|
|
|
21(4分)_______ kJ/mol。
22(9分)(1) (2)
23(7分)(1) 此时A的浓度及反应开始前容器中A、B的物质的量。
(2) B的平均反应速率。
(3) x的值。
24(10分) (1) 。
(2) 890 kJ( 填“>”、 “<”、“= ”)。
(3) 。
(4) 。
25(10分)(1)
(2) (填“增大”、“减小”、“不变”)
(3)
哈 师 大 附 中 高 二 学 年 月 考 2009、10
化 学 试 卷 答 题 纸
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
D |
C |
B |
A |
B |
B |
A |
B |
C |
D |
|
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
D |
D |
C |
C |
AB |
BC |
CD |
CD |
BC |
AB |
21(4分)+16.3 kJ/mol。
22(9分)(1) t1~t2 t3 (2)ACE
23(7分)3mol 0.75mol/L
0.05mol/(L.min)
2
24(10分) (1)H2(g) +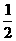 O2(g) = H2O(l) △H=-286 kJ/mol
O2(g) = H2O(l) △H=-286 kJ/mol
(2)<
(3)283akJ < Q <890akJ
(4)284.5akJ < Q <586.5akJ
25(10分)(1)50%, 1
(2)增大 66.7%
(3)<
20.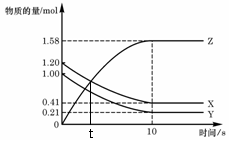 一定温度下,在2
L的密闭容器中,X、Y、Z
一定温度下,在2
L的密闭容器中,X、Y、Z
三种气体的物质的量随时间变化的曲线如右图,
下列描述不正确的是
A.t秒时该反应达到化学平衡状态
B.反应开始到10 s,X的物质的量浓度减少了0.79mol/L
C.反应开始到10s时,Y的转化率为79.0%
D.反应的化学方程式为:X(g)
+ Y(g)  2Z(g)
2Z(g)
第II卷 (40分)
19.下列说法正确的是
A.增大压强,可以使活化分子百分数增大,化学反应速率一定增大
B.升高温度,可以使活化分子百分数增大,化学反应速率一定增大
C.一般使用催化剂可以降低反应的活化能,增大活化分子百分数,增大化学反应速率
D. 加入反应物,使活化分子百分数增大,化学反应速率增大
18.下列事实不能用勒夏特列原理解释的是
A.向0.05mol/L的Fe(SCN)3溶液中加入少量固体KSCN后颜色变深
B.红棕色NO2加压后颜色先变深后变浅
C.SO2催化氧化成SO3的反应,往往需要使用催化剂
D.H2、I2、HI平衡混和气加压后颜色变深
17.一定条件下将2mol SO2和2mol SO3气体混合于一固定容积的密闭容器中,发生如下反应:
2SO2+O2  2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量可能大于n的是
2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量可能大于n的是
A.2 mol SO2 + 1 mol O2 B.1mol SO2 + 1 mol O2
C.2 mol SO2 + 1 mol O2 + 2 mol SO3 D.3 mol SO2 + 1 mol O2 + 1 mol SO3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com