
题目列表(包括答案和解析)
1.二十世纪化学合成技术的发展对人类健康水平和生活质量的提高做出了巨大贡献。下列各组物质全部由化学合成得到的是 ( )
A.玻璃 纤维素 青霉素 B.石英 橡胶 涤纶
C.尿素 食盐 聚乙烯 D.腈纶 洗衣粉 阿司匹林k.s.5.u
26.常温下,将0.05mol/L盐酸溶液和未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的pH=12。用上述NaOH溶液与pH=3的某一元弱酸溶液20ml反应,消耗了NaOH溶液13ml,试求:
(1)NaOH溶液的物质的量浓度。
(2)此一元弱酸的物质的量浓度。
(3)求此条件下该一元弱酸的电离平衡常数。
 福建省“华安、连城、永安、漳平一中,龙海二中,泉港一中”六校联考
福建省“华安、连城、永安、漳平一中,龙海二中,泉港一中”六校联考
09-10学年上学期第三次月考
25.(8分)煤化工中常需研究不同温度下平衡常数、投料比及热值等问题
已知:CO(g)+H2O(g)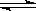 H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
|
温度/℃ |
400 |
500 |
800 |
|
平衡常数Kc |
9.94 |
9 |
1 |
试回答下列问题
(1)上述正向反应是: 反应(选填:放热、吸热)。
(2)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有
(选填A、B、C、D、E)
|
|
A |
B |
C |
D |
E |
|
n(CO2) |
3 |
1 |
0 |
1 |
1 |
|
n(H2) |
2 |
1 |
0 |
1 |
2 |
|
n(CO) |
1 |
2 |
3 |
0.5 |
3 |
|
n(H2O) |
5 |
2 |
3 |
2 |
1 |
(3)已知在一定温度下:C(s)+CO2(g) 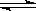 2CO(g)平衡常数K;
2CO(g)平衡常数K;
C(s) + H2O(g) 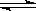 CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1;
CO(g)+H2O(g)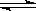 H2(g)+CO2(g)
平衡常数K2 ,
H2(g)+CO2(g)
平衡常数K2 ,
则K、K1、K2之间的关系是:

(4)在VL密闭容器中通入10molCO和10mol水蒸气,在T℃达到平衡,然后急速除去水蒸气(除水蒸气时各物质的物质的量不变),将混合气体燃烧,测得放出的热量为2842kJ(已知CO燃烧热为283kJ/mol,H2燃烧热为286kJ/mol),则T℃平衡常数K= 。
24.( 8分)(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为__ (填序号)。
A.9 B.13 C.11-13之间 D.9-11之间
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,混合溶液中
c(Na+)_______c(CH3COO-) ( “>”、“=”或“<”)。
(3)如果将HCl和CH3COONa 溶液等浓度、等体积混合,则混合溶液中各离子浓度的大小关系为___________________________________________________________。
(4) 常温下,若NaOH溶液中的c(OH―)与CH3COOH 溶液中的c(H+)相同,现将NaOH和CH3COOH的溶液分别稀释10倍,稀释后NaOH 和 CH3COOH溶液的pH分别用pH1和pH2表示。则pH1+pH2
14( “>”、“=”或“<”)
23、(4分)在密闭容器中发生下列反应: I2(g)+H2(g) 2HI(g)(正反应吸热)
2HI(g)(正反应吸热)
起始时,n(H2)=a mol,n(I2)=b mol。只改变表中列出的条件,其他条件不变,试将化学反应速率的改变(“增大”“减小”或“不变”)填入相应的表格。
|
编号 |
反应条件 |
反应速率 |
|
(1) |
加入催化剂 |
|
|
(2) |
再充入a mol H2 |
|
|
(3) |
将容器容积扩大为原来2倍 |
|
|
(4) |
通入b mol Ne(g) |
|
22、(6分)
①比较下列溶液的pH (填“>”、“<”、“=”)
(1)0.1mol/LNH4Cl______0.01mo1/L NH4Cl;
(2)0.1mol/LNa2CO3______0.1mol/L NaHCO3;
②可逆反应:aA(g)+ bB(g)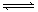 cC(g)+
dD(g);根据图回答:
cC(g)+
dD(g);根据图回答:
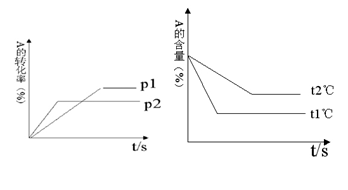
(1)压强 P1比P2 (填大或小); (2)(a +b)比(c +d) (填大或小);
(3)温度t1℃比t2℃
(填高或低);(4)正反应为
反应(填吸热或放热)
21.(共8分)写出下列物质的应用或性质有关离子方程式:
(1)饱和FeCl3溶液制Fe(OH)3胶体 ;
(2)泡沫灭火器的使用原理
(3)厨房用纯碱清洗油污 ;
(4)CO2水溶液呈酸性
20、某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)  2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是( )
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是( )
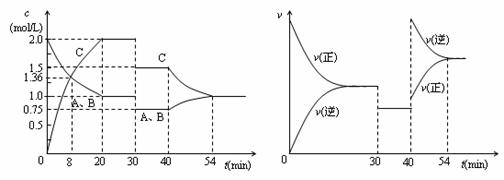
A.30min时降低温度,40min时升高温度
B.0-8min内A的平均反应速率为0.08mol/(L·min)
C.反应方程式中的x=1,正反应为吸热反应
D.20min-40min间该反应的平衡常数均为8
第Ⅱ卷(共40分)
二 填空题
19.在体积、温度都相同的条件下有下列反应:2A(g)+2B(g) C(g)+3D(g)。现分别从两条途径建立平衡:Ⅰ.A、B的起始物质的量均为2mol,Ⅱ.C、D的起始物质的量分别为2mol和6mol。以下叙述中不正确的是( )
C(g)+3D(g)。现分别从两条途径建立平衡:Ⅰ.A、B的起始物质的量均为2mol,Ⅱ.C、D的起始物质的量分别为2mol和6mol。以下叙述中不正确的是( )
A.达平衡时,Ⅰ途径的反应速率vA等于Ⅱ途径的反应速率vA
B.Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气的平均相对分子质量相同
C.Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气的百分组成相同
D.达平衡时,Ⅰ途径所得混合气的密度为Ⅱ途径所得混合气密度的1/2
18.一定温度下,反应2SO2 + O2
 2SO3,达到平衡时,n(SO2):n(O2):n(SO3) = 2:3:4。缩小体积,反应再次达到平衡时,n(SO2)=0.4mol,n(SO3)=1.4mol,此时O2的物质的量应是( )
2SO3,达到平衡时,n(SO2):n(O2):n(SO3) = 2:3:4。缩小体积,反应再次达到平衡时,n(SO2)=0.4mol,n(SO3)=1.4mol,此时O2的物质的量应是( )
A.0.4mol B.0.6mol C.0.8mol D.1.2mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com