
题目列表(包括答案和解析)
9、某温度时,浓度都是1mol·L-1的两种气体,X2、Y2在密闭容器中反应生成气体Z,达到平衡时c(X2)=0.4mol·L-1、c(Y2)=0.8mol·L-1c(Z)=0.4mol·L-1,则该反应的反应式是 ( )
A. X2+2Y2  2XY2 B. 2X2+Y2
2XY2 B. 2X2+Y2
 2X2Y
2X2Y
C. 3X2+Y2 2X3Y D. X2+3Y2
2X3Y D. X2+3Y2
 2XY3
2XY3
8、已知:①1molH2分子中化学键断裂时需要吸收436kJ的能量
②①1molCl2分子中化学键断裂时需要吸收243kJ的能量
③由H原子和Cl原子形成1molHCl分子时释放431kJ的能量
下列叙述正确的是 ( )
A.氢气和氯气反应的热化学方程式是H2(g)+Cl2(g)=2HCl(g) △H=-183kJ/mol
B.氢气与氯气反应生成2mol氯化氢气体,反应的△H=+183kJ/mol
C.氢气与氯气反应生成氯化氢气体的反应是吸热反应,
D.氢气与氯气反应生成1mol氯化氢气体,反应的△H=-183kJ/mol
7、 对可逆反应N2 + 3H2 2NH3 ,下列描述能说明反应已达平衡的是
( )
对可逆反应N2 + 3H2 2NH3 ,下列描述能说明反应已达平衡的是
( )
A.单位时间内有a mol N2消耗,同时生成2a mol NH3
B.氨气的浓度不再变化
C.容器内氮气、氢气、氨气的浓度之比为1︰3︰2
D.化学反应速率关系是:2v正(NH3) = 3v逆(H2)
6、关于化学反应速率的影响因素的说法中不正确的是 ( )
A.改变压强,若不能引起浓度的变化,反应速率就不会受影响
B.决定化学反应速率快慢的主要因素是反应物的性质
C.任何一种加快反应速率的因素都是由于增加了活化分子的百分数
D.反应速率加快的原因是有效碰撞次数增多
5、 反应2SO2+O2 2SO3经一段时间后,SO3的浓度增加了0.4mol·L-1,在这段时间内用O2表示的反应速率为0.04mol·L-1·s-1,则下列说法正确的是
( )
反应2SO2+O2 2SO3经一段时间后,SO3的浓度增加了0.4mol·L-1,在这段时间内用O2表示的反应速率为0.04mol·L-1·s-1,则下列说法正确的是
( )
A.反应经过的时间是5s B.SO2的浓度减少了0.2mol·L-1
C.SO2表示的反应速率为0.04mol·L-1·s-1 D.O2的浓度增加了0.2mol·L-1,
4、下列关于放热反应的说法中错误的是 ( )
A. 放热反应生成物分子成键时释放的总能量大于反应物分子断键时吸收的总能量
B. 放热反应反应物总能量大于产物总能量,△H<0
C. 放热反应不用加热就可以进行
D. 多数化合反应、所有的燃烧、酸碱中和反应、金属与酸反应为放热反应
3、下列说法不正确的是 ( )
A.自发过程的体系趋向于从高能状态转变为低能状态或有序转变为无序
B.知道了某过程有自发性之后,则可预测过程发生完成的快慢
C.体系的无序性越高,即混乱度越高,熵值就越大,同种物质气态时熵值最大,固态时熵值最小。
D.高温时能自发进行,在低温时逆反应能自发进行的反应是吸热的熵增加的反应
2、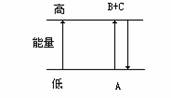 关于A、B、C三种物质之间的转化及能量变化如下图所示,下列说法中不正确的是
( )
关于A、B、C三种物质之间的转化及能量变化如下图所示,下列说法中不正确的是
( )
A.物质A具有的能量高于B和C具有的能量总和
B.对于A=B+C的过程是一个吸热的过程
C.对于A=B+C和B+C=A两个反应吸收和放出的热量相同
D.反应A=B+C是吸热过程,B+C=A必然是放热过程
1、下列说法中不正确的是 ( )
A.与煤、柴油相比较,天然气是一种比较清洁的化石燃料
B.乙醇是一种可再生能源,作为燃料的优点的是完全燃烧的产物不污染环境
C.利用太阳能、风能和氢能等能源替代化石能源能有效改善空气质量
D.煤转化为水煤气再燃烧放出的热量不会增加,因此煤的气化毫无意义
31(11分)⑴B (2)微量 C (3)元素
(4)+5, 苯或四氯化碳(2分) ③⑥(2分)
(5)分解,炒菜时不要先放盐或在烹饪快结束前再加入盐 (其余每空1分)
32(10分)(1)C A D
(2)含 ① Al(OH)3+3HCl=AlCl3+3H2O
② AlCl3+3NaOH=Al(OH)3↓+3NaCl
③Al(OH)3+NaOH=NaAlO2+2H2O (方程式每个2分,其余每空1分)
33(8分) (C6H10O5)n 、 羧基 、 氨基 、 尿素 (每空2分)
34(2分) I 、 Fe
35(2分) 弱碱性 、 偏酸性
36(3分) 非处方药 、 乙酰水杨酸 、 盘尼西林
37(4分)(1)①C6H8O6 、② 酸、 抗坏血酸 (2) 还原
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com