
题目列表(包括答案和解析)
4、下列关于铜电极的叙述正确的是( )
A.铜锌原电池中铜是负极 B.用电解法精炼粗铜时粗铜作阴极
C.在镀件上电镀铜时可用铜作阳极 D.电解食盐水时铜作阳极
3、在中和热测定的实验中不需要用到的仪器是( )
A.量筒 B.温度计 C.环形玻璃搅拌棒 D.天平
2、原电池的负极一定是( )
A.活泼金属 B.电子流出的电极
C.在反应中氧化性较强的物质 D.本身或在电极上发生还原反应
1.下列过程是非自发的是 ( )
A.水由高处向低处流 B.天然气的燃烧
C.铁在潮湿空气中生锈 D.室温下水结成冰
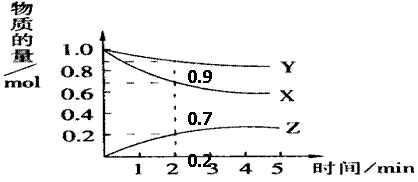
14、(6分)某温度时,图中曲线X,Y,Z是在2L容器中X,Y,Z三种物质的物质的量随时间的变化曲线。由图中数据分析,该反应的化学方程式为 ;
反应从开始计时,2分钟内Z的平均反应速率为____ 。
13、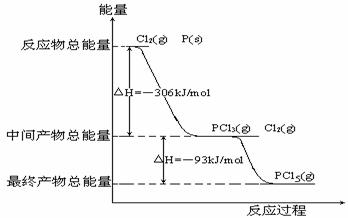 (6分)红磷P(s)和Cl2发生反应生成PCl3(g)和PCl5(g),反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)
(6分)红磷P(s)和Cl2发生反应生成PCl3(g)和PCl5(g),反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)
根据上图回答下列问题
(1)、P和Cl2反应生成PCl3的热化学方程式 ;
(2)、PCl5分解生成PCl3和Cl2的热化学方程式 ;
(3)、P和Cl2分两步反应生成1mol PCl5的△H3= ;
12、(1)、反应A(g)+B(g)  C(g) +D(g) 过程中的能量变化如图所示,
该反应是_____
_____反应(填“吸热”“放热”); △H=
kJ/mol(用E1, E2来表示数值。)
C(g) +D(g) 过程中的能量变化如图所示,
该反应是_____
_____反应(填“吸热”“放热”); △H=
kJ/mol(用E1, E2来表示数值。)

(2)、已知,

试计算△H= (用△H1,△H2来表示。)
(3)、已知H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol,计算下列反应放出的热量。
①、用1mol NaOH 配成稀溶液跟足量稀盐酸反应,放出热量为 ;
②、用0.1molBa(OH)2配成稀溶液跟足量稀硝酸反应,放出热量为 ;
③、用1mol醋酸稀溶液和足量NaOH溶液反应,放出的热量 (大于、小于、等于)57.3kJ,理由是 。
11.(1)、0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中完全燃烧,生成固态B2O3和液态水,放出649.5kJ热量,其热化学方程式为: ;
(2)、某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知: N2(g)+2O2(g)==2NO2(g) △H1=+67.2kJ/mol
N2H4(g)+O2(g)==N2(g)+2H2O(l) △H2=-534kJ/mol
假如都在相同状态下,请写出发射火箭反应的热化学方程式 ;
(3)、甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和水。已知室温下1g甲硅烷自燃放出44.6kJ热量,其热化学方程式为: ;
(4)、铝在纯氧中燃烧,每生成1 mol Al2O3(固)放出QkJ热量,写出其热化学方程式 。
10.反应4NH3+5O2 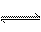 4NO+6H2O,在5L的密闭容器中进行半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率υ(x)(表示反应物的消耗速率或生成物的生成速率)为( )
4NO+6H2O,在5L的密闭容器中进行半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率υ(x)(表示反应物的消耗速率或生成物的生成速率)为( )
A.υ(O2)=0.01 mol·L-1·s-1
B.υ(NO)=0.008 mol·L-1·s-1
C.υ(H2O)=0.003 mol·L-1·s-1
D.υ(NH3)=0.002 mol·L-1·s-1
第二卷 (56分)
9.对于可逆反应N2+3H2  2NH3下列各项所表示的反应速率最快的是
2NH3下列各项所表示的反应速率最快的是
A.V(N2)=0.01mol/(L·S) ( )
B.V(H2)=0.2mol/(L·S)
C.V(H2)=0.6mol/(L·min)
D.V(NH3)=1.2mol/(L·min)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com