
题目列表(包括答案和解析)
1.下列物质属于纯净物的是
A. 氯水 B. 氨水 C. 煤 D. 明矾
24.(7分)
烟草不完全燃烧时产生的一氧化碳被吸进肺里跟血液中的血红蛋白(用Hb表示)化合,发生下述反应:CO+Hb·O2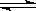 O2+Hb·CO
O2+Hb·CO
实验表明,Hb·CO的浓度即使只有Hb·O2浓度的2%,也足以使人智力受损。当空气中的CO浓度较大时,人体就感到缺氧,胸闷,此时血液中羰基血红蛋白(Hb·CO)达到10%,上述反应的平衡常数为K=[O2][Hb·CO]/[CO][Hb·O2]。是一个不受浓度影响的常数,在人体体温37℃下,该常数为220。试回答:
(1)煤气中毒病人,可以通过进入高压氧舱的方法来救治,请用化学平衡的原理加以说明:
(2)若使人的智力不受到损伤,[CO]与[O2]的比值应 (<、>或=) 。
(3)抽烟后,吸入肺部的空气测得CO和O2的浓度分别为10-6mol/L和10-2mol/L。这时Hb·CO的浓度是Hb·O2浓度的多少倍?这时候是否达到损伤人的智力的程度?请通过计算回答。
23. (4分)已知难溶于水的盐在水中存在溶解平衡:AgCl(s)
(4分)已知难溶于水的盐在水中存在溶解平衡:AgCl(s) Ag++Cl-
Ag++Cl-
在一定温度下,水溶液中Ag+的物质的量浓度和Cl-的物质的量浓度的乘积为一常数,可用KSP表示: KSP= c(Ag+)c(Cl-)=1.8·10-10
若把足量AgCl分别放入①100 mL蒸馏水,②100 mL 0.1 mol / L NaCl溶液,③100 mL 0.1 mol / L AlCl3溶液,④100 mL 0.1 mol / L MgCl2溶液中,搅拌后,在相同温度下Ag+浓度由大到小的顺序(用序号回答)是______>______>______>______。
在0.1 mol / L AlCl3溶液中,Ag+的物质的量浓度最多为___ __mol / L。
22.(8分)A、B代表不同物质,都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合。要求;相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度。(已知HNO2是弱酸)
(1)写出化学式A2 ,B2 ;
(2)写出0.1mol·L-1的A2溶液中离子浓度大小排序 ;
(3)B1溶液中水的电离程度小于B2溶液中水的电离程度,原因是 ;
(4)若B1、B2两溶液的pH=5,则两溶液中水电离出的氢离子的物质的量浓度之比为 。Blog/?UserId=997609
21. (10分)为了在中学化学实验室验证某酸HA的酸性弱于盐酸。甲、乙、丙三位同学设计了如下方案:
(10分)为了在中学化学实验室验证某酸HA的酸性弱于盐酸。甲、乙、丙三位同学设计了如下方案:
 甲同学设计思路如下:Blog/?UserId=997609
甲同学设计思路如下:Blog/?UserId=997609
 ①用已知物质的量浓度的HA溶液、HCl溶液,分别配制pH=1的两种酸溶液各100mL;②分别取这两种溶液各10mL,加水稀释为100mL;
①用已知物质的量浓度的HA溶液、HCl溶液,分别配制pH=1的两种酸溶液各100mL;②分别取这两种溶液各10mL,加水稀释为100mL;
 ③各取相同体积的两种稀释液装入两个试管:同时加入纯度相同的锌粒,观察现象即可证明。
③各取相同体积的两种稀释液装入两个试管:同时加入纯度相同的锌粒,观察现象即可证明。
 乙同学认为甲同学的设计有缺陷,作了如下改进:
乙同学认为甲同学的设计有缺陷,作了如下改进:
 第①、②步与甲相同,③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同且等质量的还原铁粉,观察现象即可证明。
第①、②步与甲相同,③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同且等质量的还原铁粉,观察现象即可证明。
 丙同学认为甲、乙同学的设计有难于实现之处,提出了如下方案:
丙同学认为甲、乙同学的设计有难于实现之处,提出了如下方案:
 ①用已知物质的量浓度的HA溶液、HCl溶液,分别配制0.1mol/L的HA溶液、HCl溶液各100mL;
①用已知物质的量浓度的HA溶液、HCl溶液,分别配制0.1mol/L的HA溶液、HCl溶液各100mL;
 ②用pH试纸测出该溶液的pH,即可证明。
②用pH试纸测出该溶液的pH,即可证明。
 (1)甲、乙方案中,说明HA的酸性弱于盐酸的现象是下列各项中的
。
(1)甲、乙方案中,说明HA的酸性弱于盐酸的现象是下列各项中的
。
A、装HCl溶液的试管中放出H2的速率快
B、装HA溶液的试管中放出H2的速率快同
C、两个试管中产生气体的速率一样快
(2)乙同学认为的甲同学的没计缺陷是 。
(3)丙同学认为甲、乙同学的设计难于实现之处是 。
(4)甲、乙、丙三同学的第①步中,都要用到的定量仪器是 。
(5)丙方案中,说明HA的酸性弱于盐酸的现象是测得HCl溶液的pH 1,HA溶液的pH 1(填“大于”、“小于”或“等于”)。
(6)请你提出一个不用HA溶液、HCl溶液而验证HA是弱酸而盐酸是强酸的方案: 。
20. (3分)分别在蒸发皿中加热蒸干氯化铝和硫酸铝溶液,最后都能得到固体,请说明所得固体有什么不同?并请解释原因。
(3分)分别在蒸发皿中加热蒸干氯化铝和硫酸铝溶液,最后都能得到固体,请说明所得固体有什么不同?并请解释原因。

 。
。
19. (13分)
(13分)
 (1)写出CH3COONa的电离方程式:
。
(1)写出CH3COONa的电离方程式:
。
 (2)写出碳酸钠溶液水解的离子方程式:
。
(2)写出碳酸钠溶液水解的离子方程式:
。
 (3)已知水中存在如下平衡:H2O+ H2O
(3)已知水中存在如下平衡:H2O+ H2O
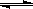 H3O++OH-; △H>0kJ·mol-1现要使平衡向右移动,且所得的溶液呈酸性,选择的方法是___________(填编号)
H3O++OH-; △H>0kJ·mol-1现要使平衡向右移动,且所得的溶液呈酸性,选择的方法是___________(填编号)
 A.向水中加入NaHSO4
B. 向水中加入Cu(NO3)2
A.向水中加入NaHSO4
B. 向水中加入Cu(NO3)2
 C. 加热水至100℃[其中c(H+)=1×10-6mol·L-1]
D. 向水中加入(NH4)2SO4
C. 加热水至100℃[其中c(H+)=1×10-6mol·L-1]
D. 向水中加入(NH4)2SO4
 (4)在容量为50mL的烧杯中放入一定量的NH4Cl晶体,用适量的水配成约20mL饱和NH4Cl溶液。然后向溶液中投入少量镁粉,使其充分反应。
(4)在容量为50mL的烧杯中放入一定量的NH4Cl晶体,用适量的水配成约20mL饱和NH4Cl溶液。然后向溶液中投入少量镁粉,使其充分反应。
 ①试分析本实验可观察到的现象;
。
①试分析本实验可观察到的现象;
。
 ②请按反应的先后顺序,写出有关离子方程式。
②请按反应的先后顺序,写出有关离子方程式。
 。
。
 (5)请选用下列试剂:酚酞、石蕊、稀氨水、氯化铵溶液、浓盐酸、熟石灰粉末、醋酸铵晶体(显中性)和蒸馏水,设计实验证明NH3·H2O在水中存在电离平衡,请简述实验方法及现象。
(5)请选用下列试剂:酚酞、石蕊、稀氨水、氯化铵溶液、浓盐酸、熟石灰粉末、醋酸铵晶体(显中性)和蒸馏水,设计实验证明NH3·H2O在水中存在电离平衡,请简述实验方法及现象。
 。
。
18. (4分)
(4分)
 (1)某温度时,水的离子积为Kw=1×10-13,则该温度
25℃(填>、=、<)。在此温度下,某溶液中由水电离出来的H+浓度为1×10-10mol/L,则该溶液的pH可能为
。
(1)某温度时,水的离子积为Kw=1×10-13,则该温度
25℃(填>、=、<)。在此温度下,某溶液中由水电离出来的H+浓度为1×10-10mol/L,则该溶液的pH可能为
。
 (2)若温度为25℃时,体积为Va、pH=a的H2SO4与体积为Vb、pH=b的NaOH混合,恰好中和。已知Va>Vb,且a=0.5b,a的取值范围
。
(2)若温度为25℃时,体积为Va、pH=a的H2SO4与体积为Vb、pH=b的NaOH混合,恰好中和。已知Va>Vb,且a=0.5b,a的取值范围
。
17.
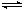 将8mlSO2与O2的混合气体在催化剂作用下发生反应2SO2(g) + O2(g) 2SO3(g),达到平衡后在相同条件下混合气体的体积变为6ml。则在原混合气体中SO2与O2的体积比可能是
( )
将8mlSO2与O2的混合气体在催化剂作用下发生反应2SO2(g) + O2(g) 2SO3(g),达到平衡后在相同条件下混合气体的体积变为6ml。则在原混合气体中SO2与O2的体积比可能是
( )
 A.4:1
B.3:1 C.2:1 D.1:1.
A.4:1
B.3:1 C.2:1 D.1:1.
 Blog/?UserId=997609
Blog/?UserId=997609
16. 可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是
可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是

 A.以NaCl溶液或NaOH溶液为电解液时,正极反应不同
A.以NaCl溶液或NaOH溶液为电解液时,正极反应不同

 B.以NaCl溶液为电解液时,负极反应为:Al+4OH--3e-=[Al(OH)4]-
B.以NaCl溶液为电解液时,负极反应为:Al+4OH--3e-=[Al(OH)4]-

 C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH减小
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH减小

 D.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com