
题目列表(包括答案和解析)
18. 物质的量浓度相同(0.1mol/L)的弱酸HX和NaX溶液等体积混合后,溶液中微粒浓度关系错误的是
物质的量浓度相同(0.1mol/L)的弱酸HX和NaX溶液等体积混合后,溶液中微粒浓度关系错误的是
 A. C(HX)+C(X-)=C(Na+)=0.1mol/L B. C(Na+)+C(H+)=C(X-)+C(OH-)
A. C(HX)+C(X-)=C(Na+)=0.1mol/L B. C(Na+)+C(H+)=C(X-)+C(OH-)
 C. 若溶液呈碱性,则C(Na+)>
C(HX)> C(X-)>C(OH-)>C(H+)
C. 若溶液呈碱性,则C(Na+)>
C(HX)> C(X-)>C(OH-)>C(H+)
 D. 若溶液呈酸性,则C(X-)>C(Na+)>C(HX)>C(H+)>C(OH-)
D. 若溶液呈酸性,则C(X-)>C(Na+)>C(HX)>C(H+)>C(OH-)

 第Ⅱ卷(非选择题 共54分)
第Ⅱ卷(非选择题 共54分)
17. 向某FeBr2溶液中,通入不1.12L (标准状况下)的Cl2,测得溶液中C(Br-)=3C(Cl-)=0.3mol/L(反应过程中溶液的体积变化及离子的水解不计)则下列说法中正确的是
向某FeBr2溶液中,通入不1.12L (标准状况下)的Cl2,测得溶液中C(Br-)=3C(Cl-)=0.3mol/L(反应过程中溶液的体积变化及离子的水解不计)则下列说法中正确的是
 A. 原溶液的浓度为0.1mol/L B.反应后溶液中C(Fe3+)=0.1mol/L
A. 原溶液的浓度为0.1mol/L B.反应后溶液中C(Fe3+)=0.1mol/L
 C. 原溶液中C(Br-)=0.4mol/L D. 反应后溶液中C(Fe3+)=2C(Fe2+)
C. 原溶液中C(Br-)=0.4mol/L D. 反应后溶液中C(Fe3+)=2C(Fe2+)
16. 高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:

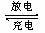 3Zn + 2K2FeO4
+ 8H2O 3Zn(OH)2
+ 2Fe(OH)3 + 4KOH
3Zn + 2K2FeO4
+ 8H2O 3Zn(OH)2
+ 2Fe(OH)3 + 4KOH
 下列叙述不正确的是
下列叙述不正确的是
 A.放电时负极反应为:Zn - 2e- +
2OH- = Zn(OH)2
A.放电时负极反应为:Zn - 2e- +
2OH- = Zn(OH)2
 B.放电时正极反应为:Fe(OH)3 - 3e- + 5OH- = FeO42-
+ 4H2O
B.放电时正极反应为:Fe(OH)3 - 3e- + 5OH- = FeO42-
+ 4H2O
 C.放电时每转移3moL电子,正极有1 mol K2FeO4被氧化
C.放电时每转移3moL电子,正极有1 mol K2FeO4被氧化
 D.放电时正极附近溶液的碱性增强
D.放电时正极附近溶液的碱性增强
15. 下列反应的离子方程式正确的是
下列反应的离子方程式正确的是
 A.将Cu粉加入FeCl3溶液中:Cu+Fe3+ =Cu2++Fe2+
A.将Cu粉加入FeCl3溶液中:Cu+Fe3+ =Cu2++Fe2+
 B.将Al粉加入NaOH溶液中:Al+2OH-+H2O=AlO2-+2H2↑
B.将Al粉加入NaOH溶液中:Al+2OH-+H2O=AlO2-+2H2↑
 C.FeI2溶液中通入少量Cl2:2I-+Cl2
=I2+2Cl-
C.FeI2溶液中通入少量Cl2:2I-+Cl2
=I2+2Cl-
 D.往KAl(SO4)2溶液加入Ba(OH)2溶液至SO42-沉淀完全:
D.往KAl(SO4)2溶液加入Ba(OH)2溶液至SO42-沉淀完全:
 2Al3+
+ 3SO42- +
3Ba2+ + 6OH-
= 2Al(OH)3↓+
3BaSO4↓
2Al3+
+ 3SO42- +
3Ba2+ + 6OH-
= 2Al(OH)3↓+
3BaSO4↓
14. 下列有关叙述正确的是
下列有关叙述正确的是
 A. 纯铁比生铁耐腐蚀
A. 纯铁比生铁耐腐蚀
 B. 甲苯和溴水混合,在铁作催化剂时能发生苯环上的取代反应
B. 甲苯和溴水混合,在铁作催化剂时能发生苯环上的取代反应
 C. 工业上用铝热反应冶炼铁
C. 工业上用铝热反应冶炼铁
 D. 使用正催化剂能加快反应速率,缩短到达平衡的时间,提高反应物的转化率
D. 使用正催化剂能加快反应速率,缩短到达平衡的时间,提高反应物的转化率
13.
 某有机物链状分子中含n个-CH2-,m个 -CH-,a个-CH3,其余为氯原子。则氯原子的个数为
某有机物链状分子中含n个-CH2-,m个 -CH-,a个-CH3,其余为氯原子。则氯原子的个数为
 A.2n+3m-a B.m+2-a C.n+m+a D.m+2n+2-a
A.2n+3m-a B.m+2-a C.n+m+a D.m+2n+2-a
12. 下列各组离子⑴I-、ClO-、NO3-、Cl- ⑵K+、NH4+、HCO3-、OH- ⑶SO32-、SO42-、Cl-、OH- ⑷Fe2+、Cu2+、SO42-、Cl- ⑸Fe3+、SCN-、K+、SO42- ⑹H+、K+、AlO2-、HSO3- 在溶液中能大量共存的组别共有
下列各组离子⑴I-、ClO-、NO3-、Cl- ⑵K+、NH4+、HCO3-、OH- ⑶SO32-、SO42-、Cl-、OH- ⑷Fe2+、Cu2+、SO42-、Cl- ⑸Fe3+、SCN-、K+、SO42- ⑹H+、K+、AlO2-、HSO3- 在溶液中能大量共存的组别共有
 A.1组
B.2组 C.3组 D.不少于4组
A.1组
B.2组 C.3组 D.不少于4组
11. NA为阿伏加德罗常数,下列说法正确的是
NA为阿伏加德罗常数,下列说法正确的是
 A.标准状况下,11.2L的戊烷所含的分子数为0.5NA
A.标准状况下,11.2L的戊烷所含的分子数为0.5NA
 B.28g乙烯所含共价键数目为6NA
B.28g乙烯所含共价键数目为6NA
 C.标准状况下,铝和NaOH溶液反应生成11.2L气体时,电子转移数为NA
C.标准状况下,铝和NaOH溶液反应生成11.2L气体时,电子转移数为NA
 D.1L1mol/L的AlCl3溶液中的Al3+的个数为NA
D.1L1mol/L的AlCl3溶液中的Al3+的个数为NA
10.某温度下,在容积固定的密闭容器中,发生可逆反应中A(g)+2B(g) 2Q(g)平衡时,各物质的浓度比为C(A):C(B):C(Q)=1:1:2,保持温度不变,以1:1:2的体积比再充入A.B.Q,则下列叙述正确的是
 A. 刚充入时反应速率V(正)减小,V(逆)增大
A. 刚充入时反应速率V(正)减小,V(逆)增大
 B. 达到新的平衡时,反应混合物中A.B的体积分数增加
B. 达到新的平衡时,反应混合物中A.B的体积分数增加
 C. 达到新的平衡时,
C(A):C(B):C(Q)仍为1:1:2
C. 达到新的平衡时,
C(A):C(B):C(Q)仍为1:1:2
 D. 达到新的平衡过程中,体系压强先增大,后减小
D. 达到新的平衡过程中,体系压强先增大,后减小
9.向硝酸钠溶液中加入铜粉不发生反应,若再加入某种盐,则铜粉可以逐渐溶解,符合此条件的盐是
 A. Fe(NO3)3 B.ZnSO4 C. NaHSO4 D. NaHCO3
A. Fe(NO3)3 B.ZnSO4 C. NaHSO4 D. NaHCO3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com