
题目列表(包括答案和解析)
11. 用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1molCu(OH)2后恰好恢复到电解前的浓度和pH。则电解过程中转移的电子数为
用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1molCu(OH)2后恰好恢复到电解前的浓度和pH。则电解过程中转移的电子数为
 A.0.1mol
B.0.2mol
C.0.3mol
D.0.4mol
A.0.1mol
B.0.2mol
C.0.3mol
D.0.4mol
10. 运用中和热的测定方法,既保温、隔热的条件下,向盛有20
mL 2.08mol/L的NaOH溶液的试管中分五次加入1-5mL未知浓度的H2SO4(边加边振荡,且每次加入1mL)后,测得溶液的温度分别是1.4℃,2.5℃,4.2℃,5.2℃,5.18℃,则该H2SO4溶液的物质的量浓度是
运用中和热的测定方法,既保温、隔热的条件下,向盛有20
mL 2.08mol/L的NaOH溶液的试管中分五次加入1-5mL未知浓度的H2SO4(边加边振荡,且每次加入1mL)后,测得溶液的温度分别是1.4℃,2.5℃,4.2℃,5.2℃,5.18℃,则该H2SO4溶液的物质的量浓度是
 A.20.8mol/L
B.4.16mol/L C.6.9mol/L D.5.2mol/L
A.20.8mol/L
B.4.16mol/L C.6.9mol/L D.5.2mol/L
9. 0.1mol/L硫代硫酸钠溶液和0.1mol/L的硫酸溶液各5ml与10ml水混合,反应速率为v1mol/(L·s),0.15mol/L硫代硫酸钠溶液和0.15mol/L的硫酸溶液各5ml与20ml水混合,反应速率为v2mol/(L·s),则v1和v2的关系是Blog/?UserId=997609
0.1mol/L硫代硫酸钠溶液和0.1mol/L的硫酸溶液各5ml与10ml水混合,反应速率为v1mol/(L·s),0.15mol/L硫代硫酸钠溶液和0.15mol/L的硫酸溶液各5ml与20ml水混合,反应速率为v2mol/(L·s),则v1和v2的关系是Blog/?UserId=997609
 A.大于 B.小于 C.等于 D.不能确定
A.大于 B.小于 C.等于 D.不能确定
8. 在恒温下的密闭容器中,有可逆反应A2(g)+B2(g)
在恒温下的密闭容器中,有可逆反应A2(g)+B2(g)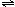 2AB(g),达到平衡的标志是
2AB(g),达到平衡的标志是
 A.容器内总压强不随时间变化
A.容器内总压强不随时间变化
 B.混和物中A2、B2和AB的百分含量一定
B.混和物中A2、B2和AB的百分含量一定
 C.混和物中A2、B2和AB各浓度相等
C.混和物中A2、B2和AB各浓度相等
 D.单位时间内生成n mol A2 ,同时生成n mol B2
D.单位时间内生成n mol A2 ,同时生成n mol B2
7. 一种新燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料说法正确的是
一种新燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料说法正确的是
 A.在熔融电解质中,O2-由负极移向正极
A.在熔融电解质中,O2-由负极移向正极
 B.电池的总反应是:2C4H10 + 13O2
→ 8CO2 + 10H2O
B.电池的总反应是:2C4H10 + 13O2
→ 8CO2 + 10H2O
 C.通入空气的一极是正极,电极反应为:O2 + 4e- = 2O2-
C.通入空气的一极是正极,电极反应为:O2 + 4e- = 2O2-
 D.通入丁烷的一极是正极,电极反应为:C4H10
+ 26e- + 13O2 = 4CO2 + 5H2O
D.通入丁烷的一极是正极,电极反应为:C4H10
+ 26e- + 13O2 = 4CO2 + 5H2O
6. 3A(g)+B(g)
3A(g)+B(g)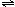 XC(g)+2D(g)在容器为2升的密闭容器中,使3molA和2.5molB发生以上反应,经过5分钟后达到平衡状态,生成1molD,经测定5分钟内C的平均反应速率是0.1mol/(l·min),根据计算结果判断以下结论错误的是
XC(g)+2D(g)在容器为2升的密闭容器中,使3molA和2.5molB发生以上反应,经过5分钟后达到平衡状态,生成1molD,经测定5分钟内C的平均反应速率是0.1mol/(l·min),根据计算结果判断以下结论错误的是
 A.5分钟内A的平均反应速率是0.15mol/(l·min)
A.5分钟内A的平均反应速率是0.15mol/(l·min)
 B.平衡时,B的转化率是20%
B.平衡时,B的转化率是20%
 C.A的平衡浓度是0.5mol/l
C.A的平衡浓度是0.5mol/l
 D.在其他条件不变时,通入惰性气体,反应容器内压强增大,反应速率增大
D.在其他条件不变时,通入惰性气体,反应容器内压强增大,反应速率增大
5.X、Y、Z、M代表四种金属元素,金属X和Z用导线连接放入稀硫酸中时,X溶解,Z上有H2放出;若电解Y2+和Z2+共存的溶液时,Y先析出;又知M2+的氧化性强于Y2+。则这四种金属的活动性由强到弱的顺序是
A.XYZM B.XZYM C.MZXY D.XZMY
4.已知:C(s)+CO2(g)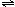 2CO(g);△H>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是
2CO(g);△H>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是
A.升高温度和减小压强 B.降低温度和减小压强
C.降低温度和增大压强 D.升高温度和增大压强
3.设C+CO2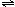 2CO;△H1>0反应速率为v1
,N2+3H2
2CO;△H1>0反应速率为v1
,N2+3H2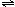 2NH3;△H2<0反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为
2NH3;△H2<0反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为
A.同时增大 B.同时减小
C.v1增大,v2减小 D.v1减小,v2增大
2.同温同压下,下列各热化学方程式中反应热数值最小的是(均为吸热反应)
A.2A(l)+B(l)=2C(g);△H=+Q1KJ·mol-1
B.2A(g)十B(g)=2C(g);△H=+Q2KJ·mol-1
C.2A(g)十B(g)=2C(1);△H=+Q3KJ·mol-1
D.2A(l)十B(1)=2C(1);△H=+Q4KJ·mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com