
题目列表(包括答案和解析)
21. (8分)能源是人类生存和发展的重要支柱。研究化学反应中的能量变化在能源紧缺的今天具有重要的意义。已知下列热化学方程式:
(8分)能源是人类生存和发展的重要支柱。研究化学反应中的能量变化在能源紧缺的今天具有重要的意义。已知下列热化学方程式:
 ①2H2(g)+O2(g) =
2H2O(l);△H
=-570KJ/mol;② H2(g)+1/2O2(g) = H2O(g);△H =-242KJ/mol;
①2H2(g)+O2(g) =
2H2O(l);△H
=-570KJ/mol;② H2(g)+1/2O2(g) = H2O(g);△H =-242KJ/mol;
 ③
C(s)+1/2O2(g)
= CO(g);△H =-110.5KJ/mol;④ C(s)+O2(g) =
CO2(g);△H
=-393.5KJ/mol;
③
C(s)+1/2O2(g)
= CO(g);△H =-110.5KJ/mol;④ C(s)+O2(g) =
CO2(g);△H
=-393.5KJ/mol;
⑤ CO2(g)+2H2O(g) = 2CH4(g)+2O2(g);△H =+890KJ/mol;回答下列问题:
(1)上述反应中属于放热反应的是 (填序号)
(2)H2的燃烧热为
(3)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然难直接测量,但可通过间接的方法求得。已知:C(s)+H2O(g) = H2(g) +CO (g) △H = aKJ/mol;则a= ;该反应的熵△S 0(选填“>”、“=”、“< ”);又已知:△G=△H-T△S(T指温度),当△G<0时可自发进行。则该反应在什么条件下可自发进行 。
20. (12分)(1)将6摩H2和3摩CO充入容积为0.5L的密闭容器中,进行如下反应:2H2(g)+CO(g))
(12分)(1)将6摩H2和3摩CO充入容积为0.5L的密闭容器中,进行如下反应:2H2(g)+CO(g))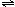 CH3OH(g)。6秒时体系达到平衡,此时容器内压强为开始时的0.6倍,则H2的反应速率为 ,CO的转化率为 。
CH3OH(g)。6秒时体系达到平衡,此时容器内压强为开始时的0.6倍,则H2的反应速率为 ,CO的转化率为 。
 (2) 按下列要求写出电极反应方程式:
(2) 按下列要求写出电极反应方程式:
 ①总反应为:Ag2O+Zn+H2O=Zn(OH)2+2Ag,电解质溶液为碱性介质溶液
①总反应为:Ag2O+Zn+H2O=Zn(OH)2+2Ag,电解质溶液为碱性介质溶液
 正极:
正极:
 负极:
负极:
 ②碱性介质中的氢氧燃料电池的电极反应方程式
②碱性介质中的氢氧燃料电池的电极反应方程式
 正极:
正极:
 负极:
负极:
19. (6分)反应2A
(6分)反应2A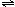 B + C在某温度下达到平衡时:
B + C在某温度下达到平衡时:
 ⑴若温度升高,平衡向正反应方向移动,则此反应的正反应为 反应(放热或吸热)。
⑴若温度升高,平衡向正反应方向移动,则此反应的正反应为 反应(放热或吸热)。
 ⑵如果B是固体,在降低平衡体系的压强时,平衡向逆反应方向移动,则A是 态。
⑵如果B是固体,在降低平衡体系的压强时,平衡向逆反应方向移动,则A是 态。
 ⑶如果已知A是气态,增加平衡体系的压强时,平衡不发生移动,则B是 态。
⑶如果已知A是气态,增加平衡体系的压强时,平衡不发生移动,则B是 态。
18. 向某密闭容器中充入1molCO和2molH2O(g),发生反应:CO+H2O
(g)
向某密闭容器中充入1molCO和2molH2O(g),发生反应:CO+H2O
(g)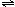 CO2
+H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是
CO2
+H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是
 A.0.5molCO+2molH2O(g)+1molCO2+1molH2
A.0.5molCO+2molH2O(g)+1molCO2+1molH2
 B.1molCO+1molH2O(g)+1molCO2+1molH2 .
B.1molCO+1molH2O(g)+1molCO2+1molH2 .
 C.0.5molCO+1.5molH2O(g)+0.4molCO2+0.4molH2
C.0.5molCO+1.5molH2O(g)+0.4molCO2+0.4molH2
 D.0.5molCO+1.5molH2O(g)+0.5molCO2+0.5molH2
D.0.5molCO+1.5molH2O(g)+0.5molCO2+0.5molH2
 第二部分(共46分)
第二部分(共46分)
17. 可逆反应N2+3H2
可逆反应N2+3H2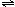 2NH3是一个放热反应。有甲、乙两个完全相同的容器,向甲容器中加入1molN2和3molH2,在一定条件下,达平衡时的热量为Q1;在相同条件下,向乙容器中加入2molNH3,达平衡时,吸收的热量为Q2。已知Q2=4Q1,则甲容器中,H2的转化率为
2NH3是一个放热反应。有甲、乙两个完全相同的容器,向甲容器中加入1molN2和3molH2,在一定条件下,达平衡时的热量为Q1;在相同条件下,向乙容器中加入2molNH3,达平衡时,吸收的热量为Q2。已知Q2=4Q1,则甲容器中,H2的转化率为
 A.20% B.25% C.75% D.80%
A.20% B.25% C.75% D.80%
16. 镍-镉可充电电池,电极材料是Cd和NiO(OH),电解质是KOH,放电时的电极反应式是
镍-镉可充电电池,电极材料是Cd和NiO(OH),电解质是KOH,放电时的电极反应式是
 Cd+2OH--2e-=Cd(OH)2,2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH-
Cd+2OH--2e-=Cd(OH)2,2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH-
 下列说法不正确的是
下列说法不正确的是
 A.电池的总反应式是Cd+2NiO(OH)+2H2O
A.电池的总反应式是Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2
 B.电池充电时,镉元素被还原
B.电池充电时,镉元素被还原
 C.电池放电时,电池负极周围溶液的pH不断增大
C.电池放电时,电池负极周围溶液的pH不断增大
 D.电池充电时,电池的负极和电源的正极连接
D.电池充电时,电池的负极和电源的正极连接
15. 已知在某温度下,将1molSO3(g)充入一定容器的密闭容器中,反应:2SO3(g)
已知在某温度下,将1molSO3(g)充入一定容器的密闭容器中,反应:2SO3(g)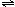 2SO2(g)
+O2(g)达到平衡时,混合气体的压强比起始时增大20%。若起始充入1mol
SO2 和1mol O2 ,在相同条件下建立平衡,则该情况下SO2转化率为
2SO2(g)
+O2(g)达到平衡时,混合气体的压强比起始时增大20%。若起始充入1mol
SO2 和1mol O2 ,在相同条件下建立平衡,则该情况下SO2转化率为
 A.20% B.20%-60% C.60% D.大于60%
A.20% B.20%-60% C.60% D.大于60%
14. 下图是在恒温密闭容器中进行的某化学反应的反应速率随时间变化的示意图。下列叙述与示意图不相符的是
下图是在恒温密闭容器中进行的某化学反应的反应速率随时间变化的示意图。下列叙述与示意图不相符的是
 A.反应达平衡时,正反应速率和逆反应速率相等
A.反应达平衡时,正反应速率和逆反应速率相等
 B.该反应达到平衡态I后,增大反应物的浓度,平衡发生移动,达到平衡态II
B.该反应达到平衡态I后,增大反应物的浓度,平衡发生移动,达到平衡态II
 C.该反应达到平衡态I以后,减小反应物浓度,平衡发生移动,达到平衡态II
C.该反应达到平衡态I以后,减小反应物浓度,平衡发生移动,达到平衡态II
 D.同一种反应物在平衡态I和平衡态II时浓度不相等。
D.同一种反应物在平衡态I和平衡态II时浓度不相等。
13. 把锌片和铁片放在盛有稀食盐水和酚酞混合液的表面皿中,如下图所示,最先观察到酚酞变红现象的区域是
把锌片和铁片放在盛有稀食盐水和酚酞混合液的表面皿中,如下图所示,最先观察到酚酞变红现象的区域是

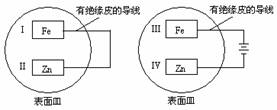

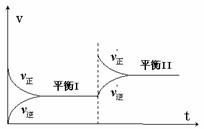 A.Ⅰ和Ⅲ B.Ⅰ和Ⅳ C.Ⅱ和Ⅲ D.Ⅱ和Ⅳ
A.Ⅰ和Ⅲ B.Ⅰ和Ⅳ C.Ⅱ和Ⅲ D.Ⅱ和Ⅳ
12. 已知298K时,
N2(g)+3H2(g)
已知298K时,
N2(g)+3H2(g)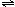 2NH3(g);△H=-92.4kJ/mol,
在相同条件下,向密闭容器中加入1molN2和3molH2,达到平衡时放出的热量为Q1,向另一容积相同的密闭容器中通入0.95molN2、2.85molH2和0.1molNH3,达到平衡时放出的热量为Q2,则下列关系式正确的是
2NH3(g);△H=-92.4kJ/mol,
在相同条件下,向密闭容器中加入1molN2和3molH2,达到平衡时放出的热量为Q1,向另一容积相同的密闭容器中通入0.95molN2、2.85molH2和0.1molNH3,达到平衡时放出的热量为Q2,则下列关系式正确的是
 A.Q1
= Q2 = 92.4kJ B.Q2
<Q1 =
92.4kJ
A.Q1
= Q2 = 92.4kJ B.Q2
<Q1 =
92.4kJ
 C.Q2<Q1<92.4kJ D.Q2
= Q1<92.4kJ
C.Q2<Q1<92.4kJ D.Q2
= Q1<92.4kJ
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com