
题目列表(包括答案和解析)
4.向20mL2mol/LAlCl3溶液中加入30mLNaOH溶液,充分反应后得到0.78g沉淀,则NaOH溶液的
物质的量浓度可能为 ( )
A.2mol/L B.3mol/L C.5mol/L D.8mol/L
3.a g铁粉与含有H2SO4的CuSO4溶液完全反应后,得到ag铜,则参与反应的CuSO4与H2SO4的
物质的量之比为 ( )
A.1:7 B.7:1 C.7:8 D.8:7
2.某溶液既能溶解AI(OH)3又能溶解H2SiO3 在该溶液中可以大量共存的离子组是( )
A.K+、Na+、HCO3-、NO3- B.Na+、SO42-、Cl-、ClO-
C.H+、Mg2+、SO42-、NO3- D.Ag+、K+、NO3-、Na+
1.在酸性溶液中除去氯化亚铁中少量的氯化铁杂质时,可选用的试剂是: ( )
①加入铁屑 ②加入NaOH溶液 ③加入铜屑 ④通入H2S ⑤通入Cl2 ⑥加入浓盐酸
A.①④ B.②⑤ C.①③ D.①③④⑥
23.(6分)难溶弱电解质在水溶液中既存在溶解平衡又存在电离平衡。
已知Cu(OH)2==Cu2++2OH- ,KSP=c(Cu2+)·[c(OH-)]2=2×l0-20。当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解。
(1)某CuSO4溶液里c(Cu2+)=0. 02mol·L-1,如要生成Cu(OH)2沉淀,应调整沉淀pH使之大于____________.
(2)要使0. 2mol·L -1CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液PH为______。
22.(10分)某化学兴趣小组用电解CuSO4溶液的方法测定铜的相对分子质量。(装置如下图所示)
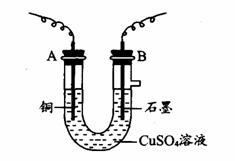
(1)若实验中测定在标准状况下放出的氧气的体积VL(氧元素的相对原子质量为16),A、B分别连接直流电源的__________和__________(填“正极”或“负极,’)。
(2)电解开始一段时间后,在U形管中可观察到的现象有______________________________________。电解的离子方程式为________________________________。
(3)实验中还需测定的数据是_______________(填写序号)。
①A极的质量增重m g
②B极的质量增重m g
(4)下列实验操作中必要的是____________(填字母);不必要的是_____________(填字母)。
A.称量电解前电极的质量
B.电解后,电极在烘干称重前,必须用蒸馏水冲洗
C.刮下电解过程中电极上析出的铜,并清洗、称重
D.电极在烘干称重的操作中必须按“烘干-称重一再烘干一再称重”进行
E.在有空气存在的情况下,烘干电极必须采用低温烘干的方法
(5)铜的相对原子质量为:_____________________________(用含有m、V的计算式表示)。
21.(7分)据报道,摩托罗拉公司开始了一种以甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月。如下图是一个电化学过程的示意图。已知甲池总反应式为:

请填空:
(1)充电时:①原电池的负极与电源_________极相连。
②阳极的电极反应式为_____________________________
(2)放电时,负极的电极反应式为__________________________
(3)在此过程中若完全反应,乙池中A极的质增加648g,则甲池中理论上消耗O2_____________L(标准状况下)。
(4)若在常温常压下,1g CH3OH燃烧生成CO2和液态H2O时放热22.68kJ,表示该反应的热化学方程式为______________________________________________。
20.(9分) DIS系统即数字化信息系统,它由传感器、数据采集器和计算机组成,某学习小组用DIS系统测定食用白醋中醋酸的物质的量浓度,以溶液的导电能力来判断滴定终点。实验步骤如下:
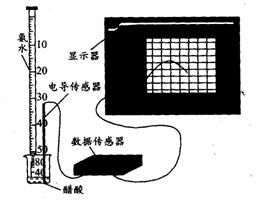
(1) 用_________________(填仪器名称)量取10. 00mL的食用白醋,在______________(填仪器名称)中用水稀释后转移到100mL________(填仪器名称)中定容,然后将稀释后的溶液倒人试剂瓶中。
(2)量取20. 00 mL的上述溶液倒入烧杯中,连接好DIS 系统(如上图),向烧杯中滴加浓度为0.1000mol·L -1的氨水,计算机屏幕上显示出溶液导电能力随氨水体积变化的曲线(见下图)。
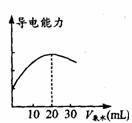
①用滴定管盛氨水前,滴定管要用__________润洗2-3遍,润洗的目的是____________________________________
②氨水与醋酸反应的离子方程式是________________________
③食用白醋中醋酸的物质的量浓度是____________________
19.(8分)(1)常温下,将1 mL pH=1的H2SO4溶液加水稀释至100mL,稀释后的溶液中C(H+)/C(OH-)=___________________
(2)某温度时,测得0. 01 mol·L-1的NaOH溶液的pH为11,则该温度下水的离子积常数KW=_____________。该温度___________25℃。
(3)常温下,设pH = 5的H2SO4的溶液中由水电离出的H+浓度为C1;pH=5的A12(SO4)3溶液中由水电离出的H+浓度为C2,则C1/C2=_______
(4)常温下,pH=13的Ba(OH)2溶液aL与PH=3的H2SO4溶液bL混合(混合后溶液体积变化忽略不计)。
若所得混合溶液呈中性,则a:b=________。
若所得混合溶液PH=12,则a:b=___________。
(5)在(2)所述温度下,将PH=a的NaOH溶液VaL与pH=b的硫酸Vb L混合。
①若所得混合液为中性,且a=12,b=2,则Va:Vb=____________
②若所得混合液的州PH=10,且a=12,b=2,则Va:Vb=____________
18.(6分)在一定温度下将2mo1 A和2mo1 B两种气体混合于2L密闭容器中,发生如下反应:3A(g)+B(g) ==2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol D,请填写下面空白:
(1)B的平衡浓度为______________。Blog/?UserId=99760
(2)A的转化率为_____________。
(3) 用D表示的平均反应速率为_________。
(4)如果缩小容器容积(温度不变),则平衡体系中混合气体的密度、平均相对分子质量 ________、________。(两空均填“增大”、“减少” 或“不变”)
(5)如果上述反应在相同条件下从逆反应开始进行,开始加C和D各4/3 mol,要使平衡时各物质的体积分数与原平衡相等,则还应加入_________mol B物质。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com