
题目列表(包括答案和解析)
1.氢能是一种既高效又干净的新能源,发展前景良好,用氢作能源的燃料电池汽车倍受青睐。我国拥有完全自主知识产权的氢燃料电池轿车“超越三号”,已达到世界先进水平,并加快向产业化的目标迈进。氢能具有的优点包括( )
①原料高.考.资.源.网广 ②易燃烧、热值高 ③储存方便 ④制备工艺廉价易行
A. ①② B. ①③ C. ③④ D. ② ④
④
16.(10分)某温度(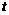 ℃)时,测得
℃)时,测得 的NaOH溶液的pH为11,则该温度下水的
的NaOH溶液的pH为11,则该温度下水的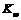 =
。则该温度(选填大于、小于或等于)
25℃,
=
。则该温度(选填大于、小于或等于)
25℃,
其理由是 。
此温度下,将pH=a的NaOH溶液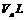 与pH=b的
与pH=b的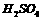 溶液
溶液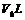 混合,通过计算填写以下不同情况时两溶液的体积比:
混合,通过计算填写以下不同情况时两溶液的体积比:
(1)若所得混合液为中性,且a=12,b=2,则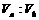 =
;
=
;
(2)若所得混合液为中性,且a+b=12,则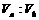 =
;
=
;
(3)若所得混合液的pH=10,且a=12,b=2,则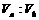 =
;
=
;
15.(14分)在一定条件下,二氧化硫和氧气发生如
下反应: 2SO2(g)+ O2 (g) 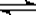 2SO3(g);△H<0
2SO3(g);△H<0
 (1)写出该反应的化学平衡常数表达式
(1)写出该反应的化学平衡常数表达式
K=
(2)降低温度,该反应K值 ,二氧化硫转化率 ,化学反应速率 。(以上均填增大、减小或不变)
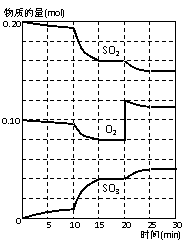
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如上图,反应处于平衡状态的时间是 。(有几段填几段)
(4)据图判断,反应进行至20min时,曲线发生变化的原因是
(用文字表达)。
10min到15min的曲线变化的原因可能是 (填写编号)。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量
14.(12分)(1)把NH4Cl晶体溶入水中,得到饱和NH4Cl溶液。若在该溶液中加入镁条,则观察到有气泡产生,点燃有爆鸣声,此气体是 ,产生该气体的原因是
__________________(用离子方程式表示)。微热后,能放出有刺激性气味的气体,它能使湿润的红色石蕊试纸变蓝,该气体是 。
(2)已知下列化学键的键能: C-H:416 kJ/mol; C-C:342 kJ/mol;C=C:613kJ/mol,H-H:436 kJ/mol,则反应CH3-CH3(g)=C2H4(g)+H2(g)的反应热△H = 。
(3)pH=12的NaOH溶液100mL,要使它的pH为11。(体积变化忽略不计)
①如果加入蒸馏水,应加 mL;
②如果加入pH=10的NaOH溶液,应加 mL;
 ③如果加0.01mol/L HCl,应加
mL。
③如果加0.01mol/L HCl,应加
mL。
13.ⅰ.(12分)某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100 mL稀H2SO4溶液;以0.14mol/L的NaOH溶液滴定上述稀 H2SO425mL,滴定终止时消耗NaOH溶液15mL。
(1)该学生用标准0.14 mol/L NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25 mL,注入锥形瓶中,加入指示剂。
B.用待测定的溶液润洗酸式滴定管。
C.用蒸馏水洗干净滴定管。
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2-3 cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E.检查滴定管是否漏水。
F.另取锥形瓶,再重复操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写): 。
②该滴定操作中应选用的指示剂是: 。
③在G操作中如何确定终点?
。
 (2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”)
,原因是
。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”)
,原因是
。
(3)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度为 mol/L(计算出结果到小数点后二位)
ⅱ.(10分)已知:(A)Cu2+,Fe2+在pH值为4-5的条件中不水解而Fe3+却几乎全部水解;
(B) 双氧水(H2O2)是强氧化剂,在酸性条件下,它的还原产物是H2O。
用粗氧化铜(CuO中含少量Fe)制取CuCl2溶液过程如下:
① 取50毫升纯净的盐酸,加入一定量的粗CuO,加热搅拌,充分反应后过滤,经测定溶液的pH值是3
② 向滤液中加入双氧水,搅拌。
③ 向②中加入过量纯CuO,微热,搅拌,此时测定溶液的pH值为4,过滤。
④ 把③所得滤液浓缩。
填空:
(I)②中发生反应的离子方程式是__________ ___________________。
(Ⅱ)③中过滤后滤渣的成分是__________________________________。
(Ⅲ)①③中如何用pH试纸测定溶液的pH值:
_____________ ___________________。
(Ⅳ)③中pH值升高的原因是:____________ _____________。(用离子式表示)
12.关于小苏打水溶液的表述正确的是
A. c(Na+)=c(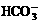 )+c(
)+c(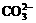 )+c(H2CO3)
)+c(H2CO3)
B. c(Na+)+c(H+)=c(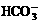 )+c(
)+c(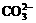 )+c(OH-)
)+c(OH-)
C. 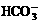 的电离程度大于
的电离程度大于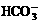 的水解程度
的水解程度
D. 存在的电离有:NaHCO3=Na++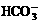 ,
,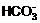

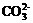 +H+。
+H+。
H2O H++OH-
H++OH-
第Ⅱ卷(共58分)
11.一定能在下列溶液中大量共存的离子组是
A. 含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl-
B. c(H+)=1×10-13mol·L-1的溶液:Na+、Ca2+、SO42-、CO32-
C. 含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN-
D. 含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl-
10.为确定某溶液的离子组成,进行如下实验:
①测定溶液的pH,溶液显强碱性。
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体。
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀。
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加Ag NO3溶液,产生白色沉淀。
根据实验以下推测正确的是
A.一定有SO32-离子 B.一定有CO32-离子
C.不能确定Cl-离子是否存在 D.不能确定HCO3-离子是否存在
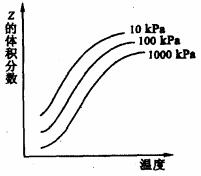
9.右图是温度和压强对X+Y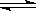 2Z反应
2Z反应
影响的示意图。图中横坐标表示平衡混合气
体中Z的体积分数。下列叙述正确的是
A.X和Y中只有一种为气态,Z为气态
B.X、Y、Z均为气态
C.上述可逆反应的正反应为放热反应
 D.上述可逆反应的正反应的ΔH>0
D.上述可逆反应的正反应的ΔH>0
8.室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是
A 0.1mol/L的盐酸和0.1mol/L的氢氧化钠溶液
 B
0.1mol/L的盐酸和0.1mol/L的氢氧化钡溶液
B
0.1mol/L的盐酸和0.1mol/L的氢氧化钡溶液
C pH=4的醋酸溶液和pH=10的氢氧化钠溶液
D pH=4的盐酸和pH=l0的氨水
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com