
题目列表(包括答案和解析)
2.pH值为3的CH3COOH和pH为11的NaOH溶液等体积混合,混合后溶液pH为( )
A. pH>7 B. pH< 7 C. pH=7 D.无法判断
1.下列物质:①盐酸 ②食盐水 ③熔化的氯化钠 ④液态氯化氢 ⑤铜 ⑥氨水 ⑦SO3 ⑧醋酸,其中可以导电并且属于强电解质的是( )
A.只有③ B.①②③⑥⑧ C.④⑤ D.全部都是
29.在一体积为10L的容器中,将1.0 mol CO与1.0 mol H2O混合加热到800℃,发生下列反应:CO(g) + H2O(g) CO2(g) + H2(g);△H<0。5min时该反应达到平衡,测得的H2O(g)物质的量为0.5 mol。
CO2(g) + H2(g);△H<0。5min时该反应达到平衡,测得的H2O(g)物质的量为0.5 mol。
(1)0~5min的平均反应速率υ(CO)=_______ mol/(L·min)。
(2)该温度下此反应的平衡常数K=________,如果升高温度K值将会__________(填“变大”,“变小”或“不变”)。
(3)判断该反应达到平衡状态的标志是 。(填字母)
A.CO和CO2浓度相等 B.CO体积分数保持不变
C.容器中气体的压强保持不变 D.CO2的生成速率与CO的消耗速率相等
E.容器中混合气体的密度保持不变 F.n(CO)/n(H2)保持不变
(4)为使该反应的反 应速率增大,且平衡向正反应方向移动的是__________。(填字母)
应速率增大,且平衡向正反应方向移动的是__________。(填字母)
A.及时分离出H2气体 B.适当升高温度
C.增大H2O的浓度 D.使用高效的催化剂
(5)为了提高CO的转化率,可向装置中再充入H2O(g)1.0mol,达新平衡时CO的转化率为 。
28.草酸晶体的组成可表示为H2C2O4·xH2O,为测定x值,进行下列实验:①称取w g草酸晶体配成100.0ml水溶液;②取25.0ml所配草酸溶液置于锥形瓶中,加入适量稀H2SO4后,用浓度为a mol/L KMnO4溶液滴定时,所发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2+2MnSO4+8H2O请回答下列问题:
(1)实验①中为配制准确浓度的草酸溶液,所需用到的玻璃仪器除胶头滴管和玻璃棒外,
还有_____________________________________。
(2)实验②中滴定时KMnO4溶液应装在________ 滴定管中,原因是 。[高.考.资.源.网:W。w。w..co。m]
(3)若滴定用的KMnO4溶液因久置而部分变质,浓度偏低,则实验所测定的x值
将___________(填“偏大”“偏小”或“无影响”)。
(4)滴定过程中,滴定终点的判断方法是________________________.
(5)若滴定时共用去a mol/L的KMnO4溶液V ml,则实验测得所配草酸溶液的物质的量浓度为_____________mol/L,由此计算出草酸晶体中的x值是___________。
27.(Ⅰ)反应A(g)+B(g)  C(g
C(g )+D(g)过程中的能量变化如图所示,回答下列问题。
)+D(g)过程中的能量变化如图所示,回答下列问题。

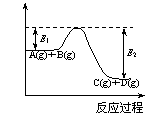 ①该反应是____________反应(填“吸热”“放热”);
①该反应是____________反应(填“吸热”“放热”);
②在反应体系中加入催化剂,反应速率增大,E1和E2的变化是: E1_________,E2________(填“增大”“减小”“不变”);
③反应体系中加入催化剂对反应热是否有影响?
_________,原因是___________________________。
(Ⅱ)已知下列两个热化学方程式;
H2(g)+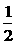 O2(g)===H2O(1); △H=-285.8kJ/mol
O2(g)===H2O(1); △H=-285.8kJ/mol
C3H8(g)+5O2(g)===3CO2(g)+4H2O(1); △H=-2220.0kJ/mol
(1)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热6262.5kJ,则混合气体中H2和C3H8的体积比是 。
(2)已知:H2O(1)=H2O(g);△H=+44.0kJ/mol。写出丙烷燃烧生成CO2和气态水的热化学方程式。 。
(3)科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质的燃料电池发电。电池正极反应为 。电池在放电过程中,H+移向电池的 (填“正”或“负”)极。
26.(I) 某温度下时,水的离子积常数KW=10-13,将此温度下PH=11的Ba(OH)2溶液aL与PH=1的H2SO4溶液bL混合(设混合溶液体积为两者之和,固体体积忽略不计)。[高.考.资.源.网:W。w。w..co。m]
(1)若a:b= 9:2,所得溶液PH=________。
(2)若混合溶液为中性,则a:b=_________,生成沉淀的物质的量为_________(最终结果可用a、b表达式来表示)。
(Ⅱ)已知pH=2的酸HA溶液与pH=12的NaOH溶液等体积混合,所得溶液显酸性。请回答下列问题:
(1)HA酸是 (填“强酸”或“弱酸” ),理由是 。
(2)0.01mol/L的HA酸溶液与pH=12的NaOH 溶液等体积混合所得溶液中pH 7(填
溶液等体积混合所得溶液中pH 7(填 <、>、=),原因是(用离子方程式表示):
。混合溶液中由水电离出的c(H+) (填<、>、=)0.01mol·L-1NaOH溶液中由水电离出的c(H+)。
<、>、=),原因是(用离子方程式表示):
。混合溶液中由水电离出的c(H+) (填<、>、=)0.01mol·L-1NaOH溶液中由水电离出的c(H+)。
25.常温下,下列有关叙述正确的是( )
A.Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
B.NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol/L
C.pH相等的①NH4Cl②(NH4)2SO4③NH4HSO4三种溶液中,c(NH4+)大小顺序:②>①>③
D.10mL pH=12的氢氧化钠溶液中加入pH=2的CH3COOH至pH刚好等于7,所得溶液体积V (总)≥20mL[高.考.资.源.网:高.考.资.源.网]
24.下列各项中的两个量,其比例为2:1的是( )
A.pH=7的氨水与(NH4)2SO4的混合溶液中,c(NH4+)与c(SO42-)之比
B.同温度下,0.2mol/LCH3COOH溶液与0.1mol/LCH3COOH溶液中的c(H+)之比
C.液面在“0”刻度,50ml酸式滴定管和25ml酸式滴定管内所盛溶液的体积
D.0.2mol/L的NH4HSO4溶液中的阳离子与阴离子之比
23.下列情况下,可以大量共存的离子组是( )
A.使pH试纸呈红色的溶液中:Fe2+、NO3-、SO42-、Na+
B.由水电离的c(H+ ) = 1×10-14
mol·L-1的溶液中:Ba2+、K+、Cl-、HCO3-
) = 1×10-14
mol·L-1的溶液中:Ba2+、K+、Cl-、HCO3-
C.与铝反应放出大量气体的溶液中:NH4+、SO42-、CO32-、Na+
D.在c(H+)/ c(OH-)=1012的溶液中:NH4+ 、Al3+、Ca2+、Cl-
22.已知25℃时,AgCl的溶度积Ksp=1.8×10-10,则下列说法正确的是( )
A.向饱和AgCl溶液中加入盐酸,Ksp值变大[高.考.资.源.网:高.考.资.源.网W。W。W..CO。M]
B.AgNO3溶液与NaCl溶液混合后的 溶液中,一定有C(Ag+)=(Cl-)
溶液中,一定有C(Ag+)=(Cl-)
C.温度一定时,当溶液中C(Ag+)×(Cl-)=Ksp时,此溶液为AgCl的饱和溶液
D.将固体AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,说明AgCl溶解度小于AgI
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com