
题目列表(包括答案和解析)
1.下列说法中,正确的是( )
A.酸式盐的溶液一定显酸性
B.只要酸与碱的物质的量浓度和体积分别相等,它们反应后的溶液就呈中性
C.纯水呈中性是因为氢离子浓度和氢氧根离子浓度相等
D.碳酸溶液中氢离子的物质的量浓度是碳酸根离子的物质的量浓度的二倍
32.(9分)(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________。
A. KMnO4 B. H2O2 C. 氯水 D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)。 ( 提示: lg5 =0.7)
福建省三明一中09-10学年高二上学期第二次月考
31. (9分)在一固定容积的密闭容器中进行着如下反应:
CO2(g)
+ H2(g) 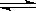 CO(g) + H2O(g) ;其平衡常数K和温度t的关系如下:
CO(g) + H2O(g) ;其平衡常数K和温度t的关系如下:
|
t℃ |
700 |
800 |
850 |
1000 |
1200 |
|
K |
2.6[ |
1.7 |
1.0 |
0.9 |
0.6 |
(1) K的表达式为: ;
(2) 该反应的正反应为 反应(“吸热”或“放热”)
(3) 能判断该反应是否已经达到化学平衡状态的是:
A.容器中压强不变 B.混合气体中CO浓度不变
C.v(H2)正 = v(H2O)逆 D.c(CO2) = c(CO)
(4) 在850℃时,可逆反应:CO2(g)
+ H2(g) 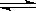 CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
|
时间/min |
CO2 (mol/L) |
H2 (mol/L) |
CO (mol/L) |
H2 O ( mol/L) |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
C1 |
c2 |
c3 |
c3 |
|
4 |
C1 |
c2 |
c3 |
c3 |
计算:3min-4min达到平衡时CO的平衡浓度c3和CO2 (g)的转化率,(列出有关的计算式,c3精确到小数点后面三位数)
。
30.(10分)在室温下,下列五种溶液:
①0.1mol/L NH4Cl ②0.1mol/L CH3COONH4 ③ 0.1mol/L NH4HSO4
④0.1mol/L NH3·H2O和0.1mol/L NH4Cl混合液 ⑤0.1mol/L NH3·H2O
请根据要求填写下列空白:
(1)溶液①呈 性(填“酸”、“碱”或“中”),其原因是
(用离子方程式表示)
(2)在上述五种溶液中,pH最小的是 ;c(NH4+)最小的是 ﹝填序号﹞
(3)比较溶液②、③中c(NH4+)的大小关系是② ③ ﹝填“>”、“<”或“=”)
(4)在溶液④中, 离子的浓度为0.1mol/L;NH3·H2O和 离子的物质的量浓度之和为0.2 mol/L
(5)室温下,测得溶液②的pH=7,则说明CH3COO-的水解程度________(填“>”、“<”或“=”) NH4+ 的水解程度,CH3COO-与NH4+浓度的大小关系是:
c(CH3COO-) c(NH4+)(填“>”、“<”或“=”)
29. (9分)现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子只能用一次,不能重复)。
|
阳离子 |
H+、Na+、A13+、Ag+、Ba2+ |
|
阴离子 |
OH-、C1-、CO32-、NO3-、SO42- |
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。
③D溶液与另外四种溶液反应都能产生沉淀; C只能与D反应产生沉淀。
试回答下列问题:
(1) 写出化学式:A___________ B___________ D_________
(2) A溶液呈碱性的原因是:(用离子方程式表示)_______________________________
(3 ) 将C溶液逐滴加入等体积、等物质量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为: 。
(4 )在100mL0.1mol·L-1 E溶液中,逐滴加入30mL 2mol·L-1NaOH溶液,最终得到沉淀物质的量为 mol
27(7分).试用离子方程式来解释下列事实:
(1)实验室配制CuSO4溶液,常常出现浑浊的原因是
(填离子方程式),可以采取在配制时加入少量 防止浑浊。
(2)普通泡沫灭火器内的玻璃筒里盛装Al2(SO4)3溶液,铁筒中盛NaHCO3溶液,使用时只要将灭火器倒持,就能迅速产生大量泡沫并喷出。其化学反应的原理是
不能把Al2(SO4)3溶液盛在铁桶中的原因是
。
28. (4分)现有①S2-、②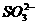 -、③
-、③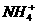 、④Al3+、⑤
、④Al3+、⑤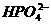 、⑥Na+、⑦
、⑥Na+、⑦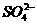 、⑧Fe3+、⑨
、⑧Fe3+、⑨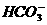 、⑩
、⑩ 等离子,请根据要求将序号填入下题:
等离子,请根据要求将序号填入下题:
(1)在水溶液中,该离子水解呈碱性的是
(2)在水溶液中,该离子水解呈酸性的是 。
(3)既能在酸性较强的溶液里大量存在,又能在碱性较强的溶液里大量存在的离子有
(4)既不能在酸性较强的溶液里大量存在,又不能在碱性较强的溶液里大量存在的离子有
26.0.1 mol•L-1 KHS溶液中下列表达式不正确的是( )
A. c(K +)+c(H+)= c(OH-)+ c(HS-)+2 c(S2-) B. c(K+)> c(HS-)> c(OH-)> c(S2-)> c(H+)[]
C. c(HS-)+ c(S2-)+ c(H2S)= 0.1 mol•L-1 D. c(K+)> c(HS-)> c(OH-)> c(H2S)> c(H+)
第Ⅱ卷(非选择题 48分)
25. (09安徽卷13)向体积为Va 的0.05mol·L-1CH3COOH溶液中加入体积为Vb的0.05mol·L-1KOH溶液,下列关系错误的是( )
A. Va>Vb时:c (CH3COOH) +c (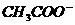 )>c
(K+)
)>c
(K+)
B. Va=Vb时:c (CH3COOH) +c (H+)>c (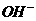 )
)
C. Va<Vb时:c
(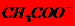 )>c (K+)>
c (OH-)> c (H+)
)>c (K+)>
c (OH-)> c (H+)
D. Va与Vb任意比时:c (K+)+ c (H+) =c (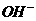 )+ c (
)+ c (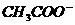 )
)
24.下列各离子浓度的大小比较,正确的是( )
A.同浓度的下列溶液中:①(NH4)2Fe(SO4)2
②(NH4)2CO3 ③(NH4)2SO4,c(NH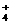 )由大到小的顺序是: ②>③>①
)由大到小的顺序是: ②>③>①
B.常温时,将等体积的盐酸和氨水混合后,当pH=7时,则c(NH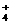 )>c(Cl-)
)>c(Cl-)
C.0.1mol·L-1Na2CO3溶液中:c(OH-)=c(HCO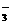 )+c(H+)+c(H2CO3)
)+c(H+)+c(H2CO3)
D.0.1 mol·L-1的NH4Cl溶液与0.05mol·L-1NaOH溶液等体积混合溶液显碱性:
c(Cl-)>c(NH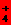 )>c(Na+)>c(OH-)>c(H+)
)>c(Na+)>c(OH-)>c(H+)
23. 下列反应的离子方程式书写正确的是( )
A. 向碘化亚铁溶液中通人足量的Cl2:2Fe2++Cl2=2Fe3++2Cl-
B. 在Ba(OH)2溶液中加NaHSO4溶液至中性:2H++SO42-+Ba2++2OH-= BaSO4↓+2H2O
C. 向NaClO溶液中通人足量 CO2气体:2ClO-+CO2+H2O = CO32-+2HClO
D. 用醋酸溶解CaCO3:CaCO3+ 2H+ = Ca2+ +CO2 ↑+H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com