
题目列表(包括答案和解析)
6.pH相同的盐酸和醋酸两种溶液中,它们的 高考资源
A.H+的物质的量相同 B.物质的量浓度相同㎡
C.H+的物质的量浓度不同 D.H+的物质的量浓度相同
5.
在温度不变的条件下,密闭容器中发生如下反应:2SO2+O2 2SO3,下列叙述能够说明反应已经达到平衡状态的是
2SO3,下列叙述能够说明反应已经达到平衡状态的是
A. 容器中SO2、O2、SO3共存
B. 反应容器中压强不随时间变化
C. 容器中SO2、O2、SO3的物质的量之比为2∶1∶2
D. SO2与SO3的浓度相等
4.
在一密闭容器内发生氨分解反应:2NH3 N2+3H2。已知NH3起始浓度是2.6 mol·L-1,4s末为1.0 mol·L-1,若用NH3的浓度变化来表示此反应的速率,则v(NH3)应为
N2+3H2。已知NH3起始浓度是2.6 mol·L-1,4s末为1.0 mol·L-1,若用NH3的浓度变化来表示此反应的速率,则v(NH3)应为
A. 1.6 mol·L-1·s-1 B. 0.8 mol·L-1·s-1
C. 0.4 mol·L-1 ·s-1 D. 0.04 mol·L-1·s-1
3.
设反应C+CO2  2CO(正反应吸热)反应速率为v1,N2+3H2
2CO(正反应吸热)反应速率为v1,N2+3H2  2NH3(正反应放热),反应速率为v2。对于上述反应,当温度升高时,v1、v2的变化情况为
2NH3(正反应放热),反应速率为v2。对于上述反应,当温度升高时,v1、v2的变化情况为
A. 同时增大 B. 同时减小
C. v1增大,v2减小 D. v1减小,v2增大
2.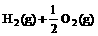 已知
已知
(l) =H2O(g) △H1=a kJ·
(2)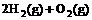 =2H2O(g)
△H2=b kJ·
=2H2O(g)
△H2=b kJ·
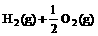
(3)=H2O(l) △H3=c kJ·
(4)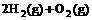 =2H2O(l)
△H4=d kJ·
=2H2O(l)
△H4=d kJ·
下列关系式中正确的是
A.a<c <0 B.b>d>0 C.2a=b<0 D.2c=d>0
1.下列说法正确的是
A.热化学方程式中,化学式前面的化学计量数既可表示微粒数,又可表示物质的量。
B.热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据。
C.书写热化学方程式时,不仅要写明反应热的符号和数值,还要注明各物质的聚集状态。
D.凡是化合反应都是放热反应,分解反应都是吸热反应。
27. (7分)热力学是专门研究能量相互转变过程中所遵循的法则的一门科学。在热力学研究中,为了明确研究的对象,人为地将所注意的一部分物质或空间与其余的物质或空间分开。被划分出来作为研究对象的这一部分称之为体系;而体系以外的其他部分则称之为环境。热化学方程式中的H实际上是热力学中的一个物理量,叫做焓,在化学上表示一个封闭体系中化学反应的能量和对环境所作的功的和。一个体系的焓(H)的绝对值到目前为止还没有办法测得,但当体系发生变化时,我们可以测得体系的焓的变化,即焓变,用“△H”表示,△H=H(终态)-H(始态)。
(1)化学反应中的△H是以__________________________的形式体现的。
对于化学反应A+B=C+D,若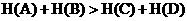 ,则该反应的△H为_______0(填“大于”、“小于”),该反应是______________(填“放热”、“吸热”)反应;
,则该反应的△H为_______0(填“大于”、“小于”),该反应是______________(填“放热”、“吸热”)反应;
(2)进一步研究表明,化学反应的焓变与反应物和生成物的键能有关。所谓键能就是:在101.3 kPa、298 K时,断开l mol气态AB为气态A、气态B时过程的焓变,用△H298(AB)表示:断开化学键时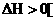 如
如 ,形成化学键时
,形成化学键时
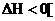 如
如 。
。
已知: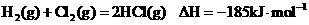
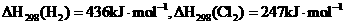
则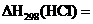 _________________________。
_________________________。
(3)Hess G.H在总结大量实验事实之后认为,只要化学反应的始态和终态确定,则化学反应的△H便是定值,与反应的途径无关。这就是有名的“Hess定律”。
己知: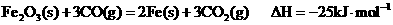
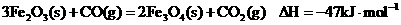
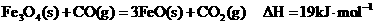
请写出CO还原FeO的热化学方程式:
______________________________________________________________________。

26.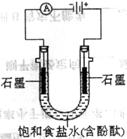 (10分)某课外活动小组进行电解饱和食盐水的实验(如图)。请同答下列问题。
(10分)某课外活动小组进行电解饱和食盐水的实验(如图)。请同答下列问题。
(1)通电一段时间后,可观察到_______________电极(填“阴
极”或“阳极”)附近溶液颜色先变红,该电极上的电极反应式为
______________________________________________。
(2)该溶液电解反应的化学方程式为__________________。
(3)若开始时改用铁棒做阳极,阳极的电极反应式为
 _________________________________________________。
_________________________________________________。
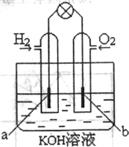
(4)若用H2和O2为反应物,以KOH为电解质溶液,可构成
新型燃料电池(如右上图),两个电极均由多孔性炭制成,通入的
气体由孔隙中逸出,并在电极表面放电。其中a是_________极
(填“正”或“负”),b极的电极反应式为_________________。
25.(9分)某研究小组将 溶液和
溶液和 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持
mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持 )。回答下列问题:
)。回答下列问题:
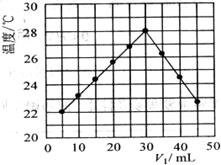
(1)研究小组做该实验时环境温度__________(填“高于”、“低于”或“等于”)22℃,判断的依据是_______________________________________________________________________
____________________________________________________________________________。
(2)由题干及图形可知,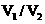 = : 时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为_________________mol·L-1。
= : 时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为_________________mol·L-1。
(3)若通过实验测定及有关计算知此反应共放出Q KJ的热量,请写出此反应的热化学
方程式:_______________________________________________________________________
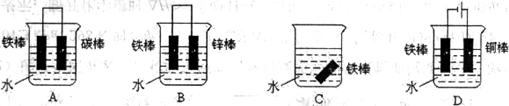
24.(6分)(1)下列哪个装置可防止铁棒被腐蚀____________________(多选倒扣分,下同)。
(2)近年来,加“碘”食盐较多使用了碘酸钾,KIO3在工业上可用电解法制取,以石墨和铁为电极,以KI溶液为电解液在一定条件下电解,反应式为: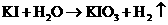 。下列有关说法中,正确的是__________________
。下列有关说法中,正确的是__________________
A.电解时,石墨做阳极,铁作阴极
B.电解时,在阳极上产生氢气
C.电解后得到KIO3产品的步骤有:过滤→浓缩→结晶→灼烧
D.电解中,每转移0.6mol电子,理论上可得到0.1mol无水KIO3晶体
(3)用铂电极电解100mL HNO3与AgNO3的混合液,通电一段时间后,两极均收集到2.24L气体(标准状况),则原混合液中Ag+的物质的量浓度为____________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com