
题目列表(包括答案和解析)
3. 25℃时,有A、B、C三种溶液,其中A溶液的pH为5,B溶液中c(H+)=10-3 mol/L,C溶液中c(OH-)=10-3 mol/L。 下列叙述正确的是
A.A溶液的酸性最强
B.将B溶液加水稀释至体积为原来的10倍,溶液中c(H+)一定等于10-4 mol/L
C.等体积的B、C混合,混合溶液的pH一定等于7
D.C溶液的pH一定等于11
2.H2(g)、CO(g)、C8H18(l)、CH4(g)的热化学方程式分别如下。相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是
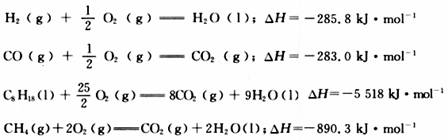
A.H2 B.CO C.C8H18 D.CH4
1.化学反应是旧键断裂和新键形成的过程。共价键的键能是两种原子间形成1 mol共价键(或其逆过程)时释放(或吸收)的能量。已知下面化学键的键能:
|
|
H-H |
Br-Br |
H-Br |
|
键能(kJ·mol-1) |
436 |
193 |
366 |
则Br2(g)+H2(g)=2HBr(g)的反应热ΔH等于
A.-183 kJ·mol-1 B.183 kJ·mol-1
C.-103 kJ·mol-1 D.103 kJ·mol-1
23、N2和H2发生合成氨反应N2(g)+3H2(g) 2NH3(g)在一定条件下达到平衡时,各物质的浓度是c(N2)=3mol/L,c(H2)=9mol/L,c(NH3)=4mol/L,求该温度时的平衡常数及N2、H2的起始浓度。
2NH3(g)在一定条件下达到平衡时,各物质的浓度是c(N2)=3mol/L,c(H2)=9mol/L,c(NH3)=4mol/L,求该温度时的平衡常数及N2、H2的起始浓度。
22.(8分)水的电离平衡曲线如下图所示。
(1)若以A点表示25℃时水在电离平衡时的离子浓度, 当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。
(2)将常温下的pH=8的Ba(OH)2溶液与常温下的pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为 。
(3)已知AnBm的离子积=[c(Am+)]n·[c(Bn-)]m?,式中c(Am+)n和c(Bn-)m表示离子的物质的量浓度。在某温度下,Ca(OH)2的溶解度为0.74 g,其饱和溶液密度设为1 g/mL,其离子积为 。
21.(4分)用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是 。
A. 配制标准溶液的氢氧化钠中混有Na2CO3杂质
B. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
 E. 未用标准液润洗碱式滴定管
E. 未用标准液润洗碱式滴定管
20.(12分)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)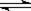 CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K = 。(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
19. (10分)将等物质的量的A、B、C、D四种物质混合,发生如下反应:aA+bB cC(s)+dD,
cC(s)+dD,
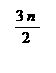
 当反应进行一定时间后,测得A减少了n mol,B减少了mol,C增加了 mol,D增加了n mol,此时达到化学平衡。
当反应进行一定时间后,测得A减少了n mol,B减少了mol,C增加了 mol,D增加了n mol,此时达到化学平衡。
(1)该化学方程式中各物质的化学计量数为:
a =_____________,b =_____________,c =_____________,d =____________。
(2)若只改变压强,反应速率发生变化,但平衡不移动,该反应中各物质的聚集状态:
A_____________,B_____________,C_____________,D_____________。
(3)若只升高温度,反应一段时间后,测得四种物质的物质的量又达到相等,则该反应为_____________反应(填“放热”或“吸热”)。
18.(6分)由氢气和氧气反应生成1mol水蒸气放热241.8kJ写出该反应的热化学反应方程式: 。若1g水蒸气转化为液态水放热2.444kJ,则反应H2(g)+1/2O2(g)==== H2O(g)的△H= kJ·mol-1。氢气的燃烧热为 kJ·mol-1。
17.(6分)在室温时,Kw= ,此时纯水中c(H+)= mol/L,c(OH-)= mol/L,当温度改变时,Kw变为4.0ⅹ10-12,些时c(H+)= mol/L,c(OH-)= mol/L,此时水的电离发生了怎样的变化: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com