
题目列表(包括答案和解析)
13.将纯水加热至80℃,下列叙述正确的是
A.水的离子积不变 B.水的pH变小,呈酸性
C.水的pH变大,呈中性 D.水中c(H+)=c(OH-)>1×10―7mol/L
12.在0.1mol/L CH3COOH溶液中存在如下电离平衡:CH3COOH
 CH3COO―+H+
CH3COO―+H+
对该平衡的叙述正确的是
A.加水稀释,平衡向逆反应方向移动
B.加入少量的KOH固体,平衡向正反应方向移动
C.加入少量的0.1mol/LHCl溶液,平衡向逆反应方向移动,溶液中c(H+)减小
 D.加入适量的CH3COONa固体,平衡向正反应方向移动
D.加入适量的CH3COONa固体,平衡向正反应方向移动
11.2.0molPCl3和1.0molCl2充入体积不变的密闭容器中,在一定条件下发生如下反应:PCl3(g)+Cl2(g) PCl5(g)。达到平衡时,PCl5为0.4mol,如果此时再向容器充入2.0molPCl3和1.0molCl2,在相同条件下达到平衡时,PCl5的物质的量为
PCl5(g)。达到平衡时,PCl5为0.4mol,如果此时再向容器充入2.0molPCl3和1.0molCl2,在相同条件下达到平衡时,PCl5的物质的量为
A.0.8mol B.大于0.4mol,小于0.8mol
C.大于0.8mol D.小于0.8mol
10.可逆反应2A(s)+2B(g)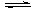 C(g)+D(g) ΔH>0,在其它条件不变时分别在不同温度(T1、T2)和压强(P1、P2)反应,C的体积分数[j(C)]随时间(t)变化的图象正确的是
C(g)+D(g) ΔH>0,在其它条件不变时分别在不同温度(T1、T2)和压强(P1、P2)反应,C的体积分数[j(C)]随时间(t)变化的图象正确的是
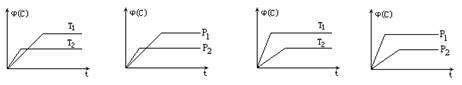
A B C D
9.下列四个吸热反应中,根据熵判据可判断不可自发进行的是
A.2CO2(g)=2CO(g)+O2(g) B.NH4Cl(s)=NH3(g)+HCl(g)
C.CaCO3=CaO+CO2(g) D.2CO(g)=2C(s)+O2(g)
8.在新制的氯水中存在平衡:Cl2+H2O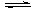 H++Cl-+HClO,若向氯水中投入少量碳酸钙粉末,溶液中发生的变化是
H++Cl-+HClO,若向氯水中投入少量碳酸钙粉末,溶液中发生的变化是
A.pH增大,HClO浓度减小 B.pH减小,HClO浓度增大
C.pH增大,HClO浓度增大 D.pH减小,HClO浓度减小
7.一定条件下,可逆反应N2+3H2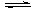 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达平衡状态的是
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达平衡状态的是
A.3v正(N2)=v正(H2) B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3) D.v正(N2)=3v逆(H2)
6.已知100℃时,水的离子积Kw=1×10-12 。对于下列100℃下的四种叙述正确的是
A.0.001mol/L的NaOH溶液的pH=11
B.0.01mol/L的盐酸与0.01mol/L的NaOH溶液等体积混合后,溶液pH=6,此时溶液呈酸性
C.pH=3的盐酸与pH=11的NaOH溶液等体积混合后,溶液呈碱性
D.0.001mol/L的盐酸的pH=1
5. 向50mL稀硫酸溶液逐滴滴加某浓度的NaOH溶液,反应过程中溶液的pH与加入NaOH溶液的体积的关系如图。下列判断正确的是
向50mL稀硫酸溶液逐滴滴加某浓度的NaOH溶液,反应过程中溶液的pH与加入NaOH溶液的体积的关系如图。下列判断正确的是
A.原稀硫酸溶液的物质的量浓度为0.01mol/L
B.滴加的NaOH溶液的物质的量浓度为0.01mol/L
C.原硫酸溶液的物质的量浓度为0.1mol/L
D.滴加的NaOH溶液的的物质的量浓度和原硫酸溶液的物质的量浓度相同
4.含NaOH 20g的稀溶液与足量稀硫酸反应,放出28.7 kJ的热量,表示该反应中和热的热化学方程式正确的是
A.2NaOH(aq)+H2SO4(aq) = Na2SO4(aq)+2H2O(l) ΔH=+57.4 kJ/mol
B.NaOH(aq)+ H2SO4(aq) =
H2SO4(aq) =  Na2SO4(aq)+H2O(l) ΔH=-28.7 kJ/mol
Na2SO4(aq)+H2O(l) ΔH=-28.7 kJ/mol
C.2NaOH(aq)+H2SO4(aq) = Na2SO4(aq)+2H2O(l) ΔH=-114.8 kJ/mol
D.NaOH(aq)+ H2SO4(aq) =
H2SO4(aq) =  Na2SO4(aq)+H2O(l) ΔH=-57.4 kJ/mol
Na2SO4(aq)+H2O(l) ΔH=-57.4 kJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com