
题目列表(包括答案和解析)
23.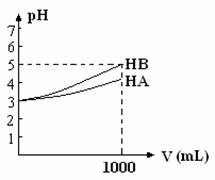 (10分)10mL pH=3的HA溶液和10mL pH=3的HB溶液各加水稀释到1000mL,稀释过程中溶液的pH与溶液体积的关系如图所示。
(10分)10mL pH=3的HA溶液和10mL pH=3的HB溶液各加水稀释到1000mL,稀释过程中溶液的pH与溶液体积的关系如图所示。
(1)写出HA、HB的电离方程式
、 。
图中表示弱酸溶液稀释过程中溶液pH和溶液体积关系的曲线是 。稀释过程中,弱酸的电离平衡向 方向移动。
(2)用pH均等于3的HA溶液和HB溶液分别中和相同体积、相同浓度的NaOH溶液至恰好完全反应,消耗的HA溶液的体积为V1,消耗的HB溶液的体积为V2,
则V1___V2(填“>”、“<”或“=”)
(3)为探究某酸HC是否为弱电解质,某同学设计了如下实验:取0.1mol/L HC溶液,用pH试纸测定该溶液的pH。要说明HC是弱电解质的理由是测得溶液的pH
。
22.(8分)已知在K2Cr2O7的溶液中存在着如下平衡:
Cr2O72-+H2O 2CrO42-+2H+
2CrO42-+2H+
(1)取两支试管各加入5 mL 0.1 mol/L K2Cr2O7溶液。向其中一支试管滴加10滴浓硫酸,现象 。
(2)向另一支试管滴加20滴6 mol/L NaOH溶液,现象 。滴加NaOH溶液的过程中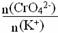 的值 (填“增大”、“减小”或“不变”),原因是 。
的值 (填“增大”、“减小”或“不变”),原因是 。
21.(8分)830℃,某反应达到平衡时,平衡常数K=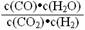 =1。恒容时,温度升高,K增大。
=1。恒容时,温度升高,K增大。
(1)该反应的化学方程式是 。
 该反应的ΔH 0(填“>”、“<”或“=”)。
该反应的ΔH 0(填“>”、“<”或“=”)。
(2)830℃时,向0.5L的容器中同时通入7molCO2、1molH2、3molCO和3molH2O后,该反应向 移动(填“正反应方向”、“逆反应方向”或“不”);平衡时n(H2)= 。
20.(8分)向一容积为2 L的密闭容器加入0.8 mol的H2和0.6 mol的I2,在一定的条件
下发生如下反应:H2(g)+I2(g) 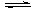 2HI(g) ΔH<0
2HI(g) ΔH<0
反应各物质的浓度随时间变化情况如图(I)。
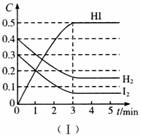
(1)根据图(I)数据,反应开始至达到平衡时,平均速率v(HI)= 。
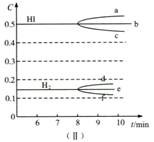
(2)反应达到平衡后,第8分钟时:
①升高温度,HI浓度的变化正确的是 。(用图(Ⅱ)中a-c的编号作答)
②若加入I2,H2浓度的变化正确的是 。(用图(Ⅱ)中d-f的编号作答)
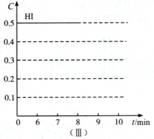
(3)反应达到平衡后,第8分钟时,若把容器的容积扩大一倍,请在图(Ⅲ)中画出8分钟后HI浓度的变化情况。
19.(6分)已知在25℃时:
① C(s)+O2(g)=CO2(g) ΔH=-394kJ/mol
② C(s)+2H2(g)=CH4(g) ΔH=-75kJ/mol
③ H2(g)+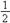 O2(g)=H2O(g) ΔH=-242kJ/mol
O2(g)=H2O(g) ΔH=-242kJ/mol
④ C(s)+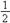 O2(g)=CO(g) ΔH=-111kJ/mol
O2(g)=CO(g) ΔH=-111kJ/mol
(1)根据①②③写出工业上利用甲烷与水蒸气反应制备氢气(同时生成CO2)的热化学方程式: 。
(2)25℃时,7g CO在氧气中充分燃烧放出的热量为 。
(3)CO的燃烧热为 。
18. 25℃时,由水电离出来的H+的浓度等于10-11mol/L的溶液有
25℃时,由水电离出来的H+的浓度等于10-11mol/L的溶液有
A.0.1mol/L 盐酸 B.0.01mol/L 盐酸
C.0.001mol/L 盐酸 D.0.001mol/L NaOH溶液
17. 甲酸和乙酸都是弱酸。25℃时,当它们的浓度均为0.10mol/L时,甲酸中的c(H+)约为乙酸中的c(H+)的3倍,乙酸溶液的pH=3。现有两种浓度不等的甲酸溶液a、b,经测定,pHa>3,pHb<3。由此可知
甲酸和乙酸都是弱酸。25℃时,当它们的浓度均为0.10mol/L时,甲酸中的c(H+)约为乙酸中的c(H+)的3倍,乙酸溶液的pH=3。现有两种浓度不等的甲酸溶液a、b,经测定,pHa>3,pHb<3。由此可知
A.a溶液的浓度小于0.1mol/L
B.a溶液的浓度大于0.1mol/L
C.b溶液的浓度小于0.1mol/L
D.b溶液的浓度大于0.1mol/L
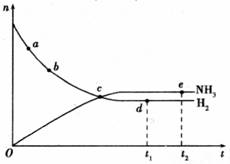
16.673K、30MPa条件下进行合成氨反应:N2(g)+3H2(g) 2NH3(g) ΔH<0。n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是
2NH3(g) ΔH<0。n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是
A.点a的正反应速率比点b的正反应速率大
B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比图中的点d (673K)时的值大
15.已知反应xA(g)+yB(g)  zC(g) 在不同温度和压强下A的转化率如下表。
zC(g) 在不同温度和压强下A的转化率如下表。
|
温度 |
不同压强下A的转化率 |
||||
|
1×105Pa |
5×105
Pa |
10×105Pa |
50×105Pa |
100×105Pa |
|
|
450℃ |
97.5% |
98.9% |
99.2% |
99.6% |
99.7% |
|
550℃ |
85.6% |
92.9% |
94.9% |
97.7% |
98.3% |
A.上述反应ΔH>0 B.上述反应ΔH<0
C.x+y>z D.x+y<z
14.某温度下,CH3COOH溶液中存在如下电离平衡:
CH3COOH
 CH3COO―+H+ K电离=1×10-5
CH3COO―+H+ K电离=1×10-5
向0.1mol/L CH3COOH溶液加入适量的CH3COONa固体,搅拌充分溶解后,测得溶液中c未电离(CH3COOH)=c(CH3COO-),此时溶液的pH等于
A.3 B.4 C.5 D.6
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com