
题目列表(包括答案和解析)
18、常温下c(OH-)最小的是 A.pH=0的溶液. B.0.05 mol·L-1 H2SO4. C.0.5 mol·L-1 HCl. D.0.05 mol·L-1的Ba(OH)2
17、甲乙两种溶液,已知甲溶液的pH值是乙溶液pH值的2倍,则甲溶液的c(H+)与乙溶液的c(H+)关系是 A. 1/2倍 B. 1/100倍 C. 100倍 D. 无法确定
16、甲酸(HCOOH)的下列性质中,可以证明它是弱电解质的是 A.1mol·L-1甲酸溶液的pH约为2 B. 甲酸能与水以任何比例互溶 C. 在不同条件下,甲酸溶液的导电性比强酸溶液的弱 D. 10mL1 mol·L-1甲酸恰好与10mL1 mol·L-1 NaOH溶液完全反应
15、在0.1mol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH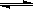 CH3COO-+H+对于该平衡,下列叙述正确的是
A.加入少量NaOH固体,平衡向逆反应方向移动
B.升高温度,平衡向正反应方向移动
C.加入水稀释,溶液中c(H+)一定增大
D.加入少量CH3COONa固体,平衡向正反应方向移动
CH3COO-+H+对于该平衡,下列叙述正确的是
A.加入少量NaOH固体,平衡向逆反应方向移动
B.升高温度,平衡向正反应方向移动
C.加入水稀释,溶液中c(H+)一定增大
D.加入少量CH3COONa固体,平衡向正反应方向移动
14、既能导电又是电解质的是 A.蔗糖溶液 B.氢氧化钾溶液 C.熔融的氯化钠 D.硫酸溶液
13、区别电解质强弱的合理依据是 A. 溶液的导电能力 B. 一定浓度时的电离程度 C. 水溶性大小 D. 与酸或碱反应时消耗酸或碱的量
1、下列溶液一定呈酸性的是
A.c(OH-)﹤c(H+)的溶液
B.含有H+离子的溶液
C.滴加酚酞显无色的溶液
D.pH小于7的溶液
2、下列溶液一定是碱性的是
A. 滴加甲基橙后溶液显红色
B. 滴加甲基橙后溶液显黄色
C. 溶液中含有OH-离子 D. 溶液中c (OH-)>c(H+)
3、纯水在20℃和80℃时的pH
A.前者大 B.后者大 C.相等 D.无法确定
4、25℃时,pH=2的HCl溶液中,由水电离出的H+离子浓度是
A.1×10-7mol/L B.1×10-12mol/L
C.1×10-2mol/L D.1×10-14mol/L
5、在某温度时,测得纯水中的c(H+)=2.4×10-7 mol/L,则c(OH-)为
A.2.4×10-7 mol/L B.0.1×10-7 mol/L
C.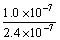 mol/L D.C(OH-)无法确定
6、有人曾建议用AG表示溶液的酸度(acidity arede),AG的定义为AG=lg([H+]/[OH-])。下列表述正确的是
A.在25℃时,若溶液呈中性,则pH=7,AG=1
B.在25℃时,若溶液呈酸性,则pH<7,AG<0
C.在25℃时,岩溶液呈碱性,则pH>7,AG<0
D.在25℃时,溶液的pH与AG的换算公式为AG=2(7-pH)
7、水的电离过程为H2O===H++OH-,在不同温度下其离子积为Kw(25℃)=1.0×10-14,Kw(100℃)=1×10-12。则下列叙述正确的是
A.c(H+)随温度的升高而降低
B.100℃时,c(H+)>c(OH-)
C.100℃时,水的pH=6 D.水的电离是放热过程
8、取浓度相同的Na0H和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为
A.0.01mol/L B.0.017mol/L
C.0.05mol/L D.0.50mol/L
9、将pH试纸用蒸馏水湿润后,去测定某溶液的pH,该溶液的pH将会
A 偏高
B 偏低 C 不变 D 上述三种情况均有可能
10、下列液体pH>7的是
A.人体血液 B.蔗糖溶液
C.橙汁
D.胃液
11、把pH=3的H2SO4溶液和pH=10的NaOH溶液混合,两者恰好中和,则两种溶液的体积比应是
A.10∶1 B.1∶10 C.1∶100 D.1∶2.
12、下列有关中和滴定的叙述中正确的是:
A.滴定时,标准液的浓度一定越稀越好
B.用盐酸作标准液滴定NaOH溶液时,指示剂加入越多越好
C.滴定管在滴液前和滴液后均有气泡一定不会造成误差
D.滴定时眼睛应注视锥形瓶内溶液的颜色变化而不应注视滴定管内的液面变化
mol/L D.C(OH-)无法确定
6、有人曾建议用AG表示溶液的酸度(acidity arede),AG的定义为AG=lg([H+]/[OH-])。下列表述正确的是
A.在25℃时,若溶液呈中性,则pH=7,AG=1
B.在25℃时,若溶液呈酸性,则pH<7,AG<0
C.在25℃时,岩溶液呈碱性,则pH>7,AG<0
D.在25℃时,溶液的pH与AG的换算公式为AG=2(7-pH)
7、水的电离过程为H2O===H++OH-,在不同温度下其离子积为Kw(25℃)=1.0×10-14,Kw(100℃)=1×10-12。则下列叙述正确的是
A.c(H+)随温度的升高而降低
B.100℃时,c(H+)>c(OH-)
C.100℃时,水的pH=6 D.水的电离是放热过程
8、取浓度相同的Na0H和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为
A.0.01mol/L B.0.017mol/L
C.0.05mol/L D.0.50mol/L
9、将pH试纸用蒸馏水湿润后,去测定某溶液的pH,该溶液的pH将会
A 偏高
B 偏低 C 不变 D 上述三种情况均有可能
10、下列液体pH>7的是
A.人体血液 B.蔗糖溶液
C.橙汁
D.胃液
11、把pH=3的H2SO4溶液和pH=10的NaOH溶液混合,两者恰好中和,则两种溶液的体积比应是
A.10∶1 B.1∶10 C.1∶100 D.1∶2.
12、下列有关中和滴定的叙述中正确的是:
A.滴定时,标准液的浓度一定越稀越好
B.用盐酸作标准液滴定NaOH溶液时,指示剂加入越多越好
C.滴定管在滴液前和滴液后均有气泡一定不会造成误差
D.滴定时眼睛应注视锥形瓶内溶液的颜色变化而不应注视滴定管内的液面变化
26.(6分)如图所示,关闭K,向A、B中均充入2molX、7molY,起始时V(A)=V(B),在相同条件下两容器均发生反应:
2X(g)+2Y(g)  Z(g)+2W(g)
Z(g)+2W(g)
达到平衡是,B中气体的密度为反应前气体密度的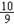 。
。
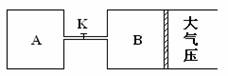
(1)平衡时,A中的Z和B中的Z的物质的量的大小比较:n(Z)A n(Z)B。
25.(4分)常温下,pH=3 的盐酸和pH=12 的NaOH溶液按溶液体积比9:2混合搅拌,求混合后溶液的pH,写出求解过程。(溶液混合过程中的体积变化忽略不计)
24.(4分)(1) 25℃时,10mL pH=2 的盐酸和VmL pH=11 的NaOH溶液混合,恰好完全反应,则V= 。
 (2) 25℃时,体积为Va、pH=a的盐酸与体积为Vb、pH=b的NaOH溶液混合后,混合溶液的pH=7。已知b=6a,Va<Vb。则a的取值范围为 。
(2) 25℃时,体积为Va、pH=a的盐酸与体积为Vb、pH=b的NaOH溶液混合后,混合溶液的pH=7。已知b=6a,Va<Vb。则a的取值范围为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com