
题目列表(包括答案和解析)
8. 将2 mol X和2 mol Y充入2 L密闭容器中发生如下反应:X(g)+3Y(g) 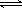 2Z(g)+aQ(g),达到平衡时生成0.8 mol Z,测得Q的浓度为0.4 mol/L,下列叙述错误的是( )
2Z(g)+aQ(g),达到平衡时生成0.8 mol Z,测得Q的浓度为0.4 mol/L,下列叙述错误的是( )
A. a的值为2 B. 平衡时X的浓度为0.2 mol/L
C. 平衡时Y的转化率为60% D. 平衡时Z的体积分数为20%
7.常温下下列各组离子能够大量共存,且溶液中由水自身电离产生的c(H+)=10-4 mol/L.满足该条件的离子组是( )
A. Ba2+、Na+、OH-、NO B. Al3+、 Ca2+、 SO
B. Al3+、 Ca2+、 SO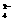 、 Br-
、 Br-
C. NH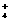 、K+ 、 Cl- 、Fe3+
D. Na+ 、Fe3+、 NO
、K+ 、 Cl- 、Fe3+
D. Na+ 、Fe3+、 NO 、H+
、H+
6.已知甲、乙、丙、丁四种溶液分别为NH4Cl、NH3·H2O、CH3COOH、NaCl中的一种,相同温度下,甲与乙两溶液PH相同,甲与丙中水的电离程度相同,则丙是( )
A. NH3·H2O B. NH4Cl C. CH3COOH D. NaCl
5.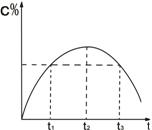 在某体积固定的密闭容器中发生如下可逆反应:
在某体积固定的密闭容器中发生如下可逆反应:
A(g)+B(g)  2C(g),在反应过程中体系的温度
2C(g),在反应过程中体系的温度
不断升高,实验测得混合气体中C的含量与温度
关系如图所示,下列说法中正确的是( )
A. 此反应的正反应是吸热反应
B. 反应在t2温度时气体对容器的压强比t3时大
C. t3温度时正反应速率大于逆反应速率
D. t3温度时正反应速率大于t1温度时正反应速率
4.常温时下列混合溶液的PH一定小于7的是( )
A. PH=3的醋酸溶液和PH=11的氢氧化钡溶液等体积混合
B. PH=3的硫酸溶液和PH=11的氢氧化钡溶液等体积混合
C. PH=3的盐酸和PH=11的氨水等体积混合
D. PH=3的硫酸溶液和PH=11氨水等体积混合
3.向四份0.1 mol/L的CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3、NaCl固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为( )
A. 减小、增大、减小、不变 B. 增大、减小、减小、增大
C. 减小、增大、增大、减小 D. 增大、减小、增大、不变
2.取浓度相同的NaOH和HCl溶液以3︰2的体积比混合,所得溶液的PH等于12,则原溶液的浓度为( )
A. 0.1 mol/L B. 0.017 mol/L
C. 0.05 mol/L D. 0.50 mol/L
1.等物质的量浓度的下列溶液中, c(NH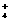 )最大的是( )
)最大的是( )
A. NH4Cl B. NH4HCO3 C. NH4HSO4 D. NH4NO3
22.(9分)实验为测定一新配制的稀盐酸的准确浓度,通常用纯净的Na2CO3(无水)配成标准溶液进行滴定。具体操作是:称取wg无水Na2CO3装入锥形瓶中,加适量蒸馏水溶解,在酸式滴定管中加入待测盐酸滴定。
(1)锥形瓶中应加入几滴指示剂,由于CO2溶解在溶液中会影响其pH,为准确起见,滴定终点宜选择在pH4-5之间,则在中学学过的几种指示剂中应选 ,
当 ,即表示达滴定终点。
(2)若滴到终点时,中和wgNa2CO3,消耗盐酸VmL,则盐酸的物质的量浓度为 mol·L-1
(3)若所称取的Na2CO3不纯,测得盐酸的浓度就不准确。现设盐酸的准确浓度为 c1mol·L-1,用不纯的Na2C03测得盐酸为c2mol·L-1在下述情况下,c1﹑c2的关系是:(下面三空填“>”、“<”或“=”)
①当Na2C03中含有NaHCO3时,则c1 c2;②当Na2C03中含有NaOH时,则cl c2;
③当Na2C03中含有Na2C03·1OH20,则c1 c2。
贵州省兴义九中09-10学年高二上学期期中考试
21.(6分)NO分子因污染空气而臭名昭著。近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究的热点,NO亦被称为“明星分子”。请回答下列问题。
(1)NO对环境的危害在于 (填以下项目的编号)
A.破坏臭氧层 B.形成化学烟雾
C.造成酸雨 D.容易转化为NO2造成二次污染
(2)汽车尾气中含有NO和CO等大气污染物,若在催化剂的作用下发生化学反应,生成参与大气循环的物质,反应的方程式为_______________________________________________________。
(3)控制城市空气污染源的方法可以有___________(多选)。
A.开发新能源 B.使用电动车
C.植树造林 D.戴上呼吸面具
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com