
题目列表(包括答案和解析)
28.(15分)实验为测定一新配制的稀盐酸的准确浓度,通常用纯净的无水Na2CO3配成标准溶液进行滴定。具体操作是:称取w g无水Na2CO3装入锥形瓶中,加适量蒸馏水溶解,在酸式滴定管中加入待测盐酸滴定。
(1)锥形瓶中应加入几滴指示剂,由于CO2溶解在溶液中会影响pH,为准确起见,滴定终点宜选择在pH 4~5之间,则在中学学过的几种指示剂应选______,当滴定溶液由_____色变成_____色时,即表示达滴定终点。
(2)若滴到终点时,中和w g Na2CO3消耗盐酸V mL,则盐酸的物质的量浓度为______mol·L-1。
(3)若所称取的Na2CO3不纯,测得盐酸的浓度就不准确。现设盐酸的准确浓度为c1mol·L-1,用不纯的Na2CO3标定测得盐酸为c2mol·L-1,在下述情况下,c1,c2的关系是(下空填>、<或=)
①当Na2CO3中含有NaHCO3时,cl_____c2;
②当Na2CO3中含有NaOH时,cl_____c2;
③当Na2CO3中含有Na2CO3·10H2O时,cl_____c2。
27.(14分)合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ/mol
2NH3(g) ΔH=-92.4kJ/mol
据此回答以下两题:
(1)合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是 (填序号)。
①20MPa~50MPa ②500℃的高温 ③铁触媒作催化剂
④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中
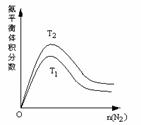 (2)一定条件下NH3的平衡体积分数随n(N2)变化如图所示
(2)一定条件下NH3的平衡体积分数随n(N2)变化如图所示
(T-温度)。则T2_____T1 (填>、=、<),判断的依据是:
________________________________________________
_______________________。
(3)相同温度下,有恒容密闭容器A、恒压密闭容器B,两容器
中均充入1molN2和3molH2,此时两容器的体积相等。在一定条
件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1kJ;B中NH3的体积分数为b,放出热量Q2kJ。则:a_____b(填>、=、<下同),Q1_____ Q2,Q1_____92.4。
26.(7分)正常雨水偏____性,pH约为____,这是因为_____________的缘故。酸雨是指pH___________的降水,主要是人为排放的________和____________等酸性气体转化而成的。
25.当前,我国正待解决的“白色污染”通常是指 ( )
A.冶炼厂的白色烟尘 B.石灰窑的白色粉尘
C.聚乙烯等塑料垃圾 D.白色建筑材料
第Ⅱ卷(非选择题,共50分)
24.下列物质中不属于合金的是 ( )
A.硬铝 B.黄铜 C.钢铁 D.水银
23.对于胃溃疡较重的病人,适合使用的抑酸剂是 ( )
A.Mg(OH)2 B.CaCO3 C.NaHCO3 D.MgCO3
22.下列液体中pH>7的是 ( )
A.人体血液 B.蔗糖溶液 C.橙汁 D.胃液
21.在一些建筑工地的食堂中,常发生将工业用盐当作食用盐而引起中毒的现象。该盐的化学式为 ( )
A.MgCl2 B.KCl C.NaNO2 D.MgSO4
20.可逆反应:3 A(g)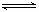 3 B(?)+ C(?); △H>0,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是:( )
3 B(?)+ C(?); △H>0,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是:( )
①B和C可能都是固体; ②B和C一定都是气体;③若C为固体,则B一定是气体; ④B和C可能都是气体;
A.①② B.②③ C.③④ D.①④
19.1 g H2完全燃烧生成液态水放出142.9 kJ热量,表示该反应的热化学方程式正确的是 ( )
A.2H2 + O2 == 2H2O ; ΔH=-571.6kJ·mol-1
B.H2(g)+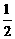 O2(g)== H2O(l) ; ΔH=-142.9 kJ·mol-1
O2(g)== H2O(l) ; ΔH=-142.9 kJ·mol-1
C.H2(g)+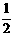 O2(g)== H2O (l) ; ΔH=-285.8 kJ·mol-1
O2(g)== H2O (l) ; ΔH=-285.8 kJ·mol-1
D.2H2(g)+O2(g)== 2H2O (g) ; ΔH=-571.6 kJ·mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com