
题目列表(包括答案和解析)
9.在一定温度下,向a L密闭容器中加入1mol X气体和2 mol Y气体,发生如下反应:X(g)+2Y(g) 2Z(g) 此反应达到平衡的标志是
( )
2Z(g) 此反应达到平衡的标志是
( )
A.容器内压强不随时间变化
B. 容器内X、Y、Z的浓度之比为1︰2︰2
 C.容器内各物质的浓度不随时间变化
C.容器内各物质的浓度不随时间变化
D.单位时间消耗0.1mol X同时生成0.2mol Z
8.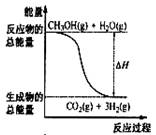 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原
理是①CH3OH(g)+H2O(g)=CO2(g)+3H2(g); △H= + 49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9 kJ·mol-1
下列说法正确的是 ( )
A.CH3OH的燃烧热为192.9 kJ·mol-1
B.反应①中的能量变化如右图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应: CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ·mol-1
7.在密闭容器中,在一定条件下,反应:NO(g) + CO(g)  1/2N2(g)
+ CO2(g);△H = -373.2
KJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是 ( )
1/2N2(g)
+ CO2(g);△H = -373.2
KJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是 ( )
A.加催化剂同时升高温度
B.加催化剂同时增大压强
C.升高温度同时充入N2
D.降低温度同时增大压强
6. 右图是温度和压强对X + Y
右图是温度和压强对X + Y  2Z
反应影响的示 意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
( )
2Z
反应影响的示 意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
( )
A.上述可逆反应的正反应为放热反应
B. Z为气态,X一定是固态
C. X、Y、Z均为气态
D.上述反应的逆反应的△H>0
5.某温度下,在一容积可变的容器中,反应2A(g)+B(g)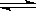 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
( )
2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
( )
A.均减半 B.均加倍
C. 均减少1mol D. 均增加1mol
4.恒温恒压下,在容积可变的器血中,反应2NO2(气)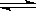 N2O4(气)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数 ( )
N2O4(气)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数 ( )
A.不变 B.增大
C.减小 D.无法判断
3.现有反应CO (g)+H2O(g) 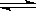 CO2(g)+ H2(g)已知1mol CO和2molH2O在一定条件下反应,达平衡时,生成0.7molCO2。若其它条件不变,将2molH2O改为4molH2O,达到新平衡时,生成的CO2的物质的量可能是
( )
CO2(g)+ H2(g)已知1mol CO和2molH2O在一定条件下反应,达平衡时,生成0.7molCO2。若其它条件不变,将2molH2O改为4molH2O,达到新平衡时,生成的CO2的物质的量可能是
( )
A. 0.65mol B. 0.83mol C. 1.0mol D. 1.4mol
2.在一定温度下的定容容器中,当下列物理量不再发生变化时,不能表明可逆反应A(固)+2B(气)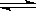 C(气)+D(气)△H>0已达到平衡状态的是 ( )
C(气)+D(气)△H>0已达到平衡状态的是 ( )
A.混合气体的压强 B.混合气体的密度
C.B的物质的量浓度 D.反应放出的热量
1.已知胆矾溶于水时溶液温度降低。胆矾分解的热化学方程式为:
CuSO4·5H2O(s) CuSO4(s)+5H2O(l);ΔH= +Q1 kJ/mol
室温下,若将1mol无水硫酸铜溶解为溶液时放热Q2 kJ,则Q1与Q2的关系为
( )
CuSO4(s)+5H2O(l);ΔH= +Q1 kJ/mol
室温下,若将1mol无水硫酸铜溶解为溶液时放热Q2 kJ,则Q1与Q2的关系为
( )
A.Q1<Q2 B.Q1=Q2 C.Q1>Q2 D.无法比较
29.(14分)某校化学兴趣小组采用酸碱中和滴定法测定学校新购入的烧碱的纯度(烧碱中含有不与酸反应的杂质),试根据实验回答。
(1)实验步骤为:
①用托盘天平准确称量4.1g烧碱样品。
②将样品配成250ml待测液,需要的玻璃仪器有__________________________。
③用________式滴定管量取10.00ml待测液,注入锥形瓶中。
④在锥形瓶中滴入2-3滴________(填指示剂),用0.2010 mol/L的标准盐酸滴定待测烧碱溶液,滴定时左手旋转____式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视___________,直到滴定终点。
(2)实验过程中,下列操作将造成待测烧碱溶液浓度偏高的是_______________。
①量取待测液的滴定管没有用待测液润洗 ②锥形瓶水洗后又用待测液润洗
③未用标准盐酸溶液润洗滴定管 ④滴定过程中振荡时有液滴溅出
⑤滴定前盛装标准盐酸溶液的滴定管尖嘴部分有气泡,滴定后无气泡
⑥滴定前仰视读数,滴定后俯视读数
(3)该小组测得下列数据
|
滴定次数 |
待测液体积/ml |
标准盐酸体积/ml |
|
|
滴定前读数/ml |
滴定后读数/ml |
||
|
第一次 |
10.00 |
0.20 |
22.60 |
|
第二次 |
10.00 |
0.50 |
20.40 |
|
第三次 |
10.00 |
4.00 |
24.10 |
|
第四次 |
10.00 |
0.00 |
20.00 |
根据上述数据,计算烧碱的纯度______________。
贵州省乌沙中学09-10学年高二上学期期中考试
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com