
题目列表(包括答案和解析)
2.乳浊液及乳化作用
[实验9-4]
|
试管内加入的物质 |
现象 |
把液体倒掉后试管是否干净 |
||
|
振荡前 |
振荡后 |
静置后 |
||
|
水和植物油 |
分层 |
浑浊 |
分层 |
不干净,附着油滴 |
|
水、植物油和洗涤剂 |
分层 |
浑浊 |
不分层 |
干净,无油滴附着 |
解释与结论:水和植物油,振荡后得到乳状浑浊的液体。在这种液体里分散着不溶于水的、由许多分子聚集成的小油滴。这种液体不稳定,静置后,植物油又浮起来,分为上下两层。这种小液滴分散到液体里形成的混合物,叫做乳浊液。加入洗涤剂后,形成的乳浊液很稳定,不再分层。这是因为洗洁精、洗衣粉等含表面活性剂,可以使食用油等物质以细小的液滴均匀分散在水中,形成乳浊液。这种现象称为乳化作用。这些小液滴能随着水流走,因此试管内壁很干净。用肥皂、洗衣粉洗衣服、用洗洁精洗碗都是这个道理。
说明:乳化并不是溶解,它是靠乳化剂将难溶物分散成无数细小的液滴均匀分散在水中。生活中洗涤用的常见物质,如洗洁精、洗衣粉、肥皂等都含有乳化剂。
泥土与水混合搅拌,得到的混合物不同于乳浊液,这时液体里悬浮着不溶于水的固体小颗粒,这种液体叫做悬浊液。
状元笔记
乳化和溶解的区别:溶解是溶质以单个分子或离子分散在溶剂中。而乳化是难溶物由大液滴分散成小液滴,每个小液滴仍是很多分子的聚合体。
[示例]洗涤剂能去油污,其原理是 ( )
A.在洗涤剂的作用下,使油污发生化学反应生成其他物质而溶于水
B.油污溶解在洗涤剂中形成溶液,从而除去油污
C.洗涤剂使油污蒸发变成气体,从而除去油污
D.洗涤剂使油污分散成细小的液滴,随水流走
解析: 洗涤剂有乳化作用,它能将大的油污分散成细小的液滴,随水流走。
答案:D
2.溶液均一、稳定,但均一、稳定的液体不一定是溶液。如水、酒精等不是溶液,它们是纯净物,而溶液是混合物。
[实验9-2] 高锰酸钾和碘分别在酒精和汽油中的溶解
在两支试管中各加入2-3 mL水,再分别加入1-2小粒碘或高锰酸钾;另外在两支试管中各加入2-3 mL汽油,也分别加入1-2小粒碘或高锰酸钾,振荡,观察。
|
溶剂 |
溶质 |
现象 |
|
水 |
碘 |
几乎不溶解 |
|
水 |
高锰酸钾 |
迅速溶解,溶液呈红色 |
|
汽油 |
碘 |
很快溶解,溶液呈红棕色 |
|
汽油 |
高锰酸钾 |
几乎不溶解 |
结论:同一种物质在不同溶剂中的溶解能力不同。
溶质和溶剂的判断:
(1)若是固体或气体与液体相互溶解成为液体,一般习惯将固体或气体看作为溶质,液体作为溶剂。
(2)若是由两种液体组成的溶液,一般习惯把量多的作为溶剂,量少的作为溶质。
(3)其他物质溶解于水形成溶液时,无论水量多少,水都是溶剂。
状元笔记
溶剂判定记忆口诀:
固气溶解液为剂,液液互溶多为剂,
水多水少总是剂,不指溶剂水为剂。
[实验9-3] 乙醇和水的溶解
在盛有2 mL水的试管中滴入2-3滴红墨水,振荡,再用滴管缓缓滴入2 mL乙醇。
|
溶剂 |
溶质 |
振荡前的现象 |
振荡后的现象 |
静置后的现象 |
结论 |
|
水 |
乙醇 |
分层 |
不分层 |
不分层 |
水和乙醇能形成溶液 |
[示例]下列溶液中溶剂不是水的是( )
A.生理盐水 B.消毒酒精 C.葡萄糖注射液 D.碘酒
解析:生理盐水是0.09%的食盐溶液,消毒酒精是75%的酒精水溶液,葡萄糖注射液是葡萄糖的水溶液,这三种溶液的溶剂都是水;而碘酒是碘的酒精溶液,溶剂不是水,而是酒精。
答案:D
1.溶液澄清、透明,但不一定无色,如硫酸铜溶液呈蓝色。
1.溶液的组成及特征
[实验9-1] 在20 mL水中加入一匙蔗糖,用玻璃棒搅拌。
现象:蔗糖不见了。
解释:蔗糖分子在水分子的作用下,向水里扩散,形成均一、稳定的混合物--蔗糖溶液。食盐是由Na+和Cl-构成的,在水分子的作用下,Na+和Cl-自由移动,形成均一、稳定的食盐水。只要水分不蒸发、温度不改变,蔗糖与水或氯化钠与水都不会分离,取出其中的一部分,成分完全相同。像这样:由一种或一种以上的物质分散到另一种物质中所形成的均一、稳定的混合物,叫溶液。
说明:①溶液的组成:溶液由溶质和溶剂组成。
溶质:被溶解的物质叫溶质(如食盐)。溶质可以是气体、固体或液体。
溶剂:起溶解作用的物质叫溶剂(如水)。水是最常见的溶剂,酒精和汽油也可以作溶剂。如酒精可以溶解碘,汽油能够溶解油脂等。
②溶液的特征:均一、稳定、混合物是溶液的基本特征。
均一性:溶液中各部分的浓度、密度、性质都相同。
稳定性:只要水分不蒸发,外界条件不变化,溶质和溶剂不会分开。
混合物:溶液至少是由两种物质组成的(也可以是由两种以上物质组成的),因而属于混合物。
[示例] (2008重庆)下列物质中不属于溶液的是 ( )
A.食盐水 B.汽水 C.泥水 D.澄清石灰水
解析:溶液是指一种物质分散到另一种物质中形成的均一、稳定的混合物,而泥土不均一、不稳定,因而不属于溶液。
答案:C
状元笔记
2.物质的溶解度曲线
活动与探究:绘制溶解度曲线
用纵坐标表示溶解度,横坐标表示温度,根据课本表9-1提供的数据,绘制几种物质的溶解度曲线。如下图所示。
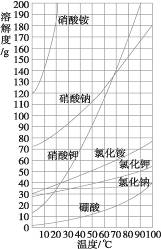
意义及应用:
①溶解度曲线表示某物质在不同温度下的溶解度。因此已知温度可以查出某物质的溶解度;已知某物质的溶解度也可以查出其对应的温度;也可以比较不同物质在同一温度时的溶解度大小。
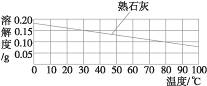
②溶解度曲线的走势表示某物质溶解度随温度的变化情况。大部分固体物质溶解度随温度的升高而增大,表现在曲线向上延伸(即上升),且比较陡,例如硝酸钾;少数固体物质的溶解度受温度的影响很小,表现在曲线比较平坦,例如氯化钠;极少数固体物质的溶解度随温度的升高而减小,表现在曲线向下延伸(即下降),例如氢氧化钙。
③两条曲线的交叉点表示两种溶质在某一对应温度下具有相同的溶解度。
④在溶解度曲线上的每一个点都表示溶质在某温度下的溶解度,此时的溶液必然是恰好饱和的溶液;在溶解度曲线下方的点,则表示溶液是不饱和溶液;在溶解度曲线上方的点,则表示未溶解的溶质与饱和溶液共存的混合物或过饱和溶液(慢慢改变饱和溶液的温度,溶液中本应析出晶体但实际还没有析出晶体,此时称过饱和溶液。这是一个不稳定状态,若搅拌或加入少量晶粒,即有大量晶体析出,溶液即变为饱和溶液)。
状元笔记
物质溶解度曲线的意义,可从点(即曲线上的点、两曲线交点)、线(曲线走势)、面(曲线上方、曲线下方)三方面去理解。
[示例]如下图,回答下列问题:

(1)t3 ℃时,三种物质的溶解度由大到小的顺序是___________。
(2)t2 ℃时,___________和___________的溶解度大小相等。
(3)三种物质中,___________的溶解度受温度的影响最大,___________的溶解度受温度的影响最小,___________的溶解度随温度的上升反而下降。
解析:沿t3点向上作垂线,分别从三条曲线上找到三个点,从高到低的顺序,也就是此时溶解度大小的顺序,即a>c>b;两条曲线的交叉点表示两种溶质在某一对应温度下具有相同的溶解度。显然,t2 ℃时a、c的溶解度大小相等;根据三曲线的走势可推出三种物质溶解度随温度的变化情况。
通过上面的实验,我们可以看出,室温时,20 mL水中溶解氯化钠和硝酸钾的质量差不多,但升高温度,硝酸钾比氯化钠溶解的要多。通常我们可以用溶解度来定量表示物质的溶解能力。
1.固体物质的溶解度
(1)概念
固体物质的溶解度是指在一定温度下,该物质在100 g溶剂(通常溶剂为水)达到饱和状态时所溶解的质量。
说明:①条件:在一定温度下。
温度是影响固体物质溶解度的重要因素。不同温度下,固体物质的溶解度不同,如硝酸钾在20 ℃的溶解度是31.6 g,而在60 ℃的溶解度是110 g。因此只有指明温度时,溶解度才有意义。
②标准:在100 g溶剂里。
溶解度的标准是统一的,即规定在100 g溶剂里。这里尤其需要注意,是在100 g溶剂里,而不是在100 g溶液里。
③状态:达到饱和状态。
达到饱和状态,即物质的溶解达到了最大限度,才能体现出某种物质的溶解能力大小。
④量:质量,单位通常为克。
状元笔记
理解溶解度概念要抓住四个要素,即①条件:一定温度;②标准:100 g溶剂;③状态:饱和状态;④量:质量(克)。
(2)固体溶解度与溶解性的关系
|
溶解性 |
易溶 |
可溶 |
微溶 |
难溶 |
|
溶解度(室温)/g |
大于10 |
1-10 |
0.01-1 |
小于0.01 |
说明:室温一般指的是在20 ℃时。
[示例]下列对“20 ℃时,硝酸钾的溶解度为31.6 g”的解释正确的是( )
A.20 ℃时,31.6 g硝酸钾溶解在水中
B.20 ℃时,100 g溶液中含31.6 g硝酸钾
C.31.6 g硝酸钾溶解在100 g水中达到饱和状态
D.20 ℃时,31.6 g硝酸钾溶解在100 g水中恰好达到饱和状态
解析:固体物质的溶解度是指在一定温度下某固态物质在100 g溶剂(通常溶剂为水)里达到饱和状态时所溶解的质量。A中未指明溶剂量100 g及溶液达到饱和状态;B中溶液为100 g而不是溶剂为100 g,也未指明溶液达到饱和状态;C中未指明温度,因此A、B、C都是错误的。只有D的理解符合溶解度的四要素,是正确的。
答案:D
溶质从溶液中以晶体的形式析出的过程,叫做结晶。结晶通常有两种方法:
(1)蒸发溶剂,如将氯化钠溶液蒸发水分,就可以析出氯化钠晶体。
(2)改变饱和溶液温度,如将硝酸钾溶液降温,也可以析出硝酸钾晶体。
利用蒸发溶剂结晶的方法可以从海水中提取食盐。其过程是:先将海水引入蒸发池,经风吹日晒蒸发水分到一定程度,再导入结晶池,继续风吹日晒就逐渐析出食盐来。
海水→贮水池→蒸发池→结晶池→

[示例]下图是利用海水提取食盐的过程:

(1)上图中①是______池(填“蒸发”或“冷却”)。
(2)根据海水晒盐的原理,判断下列分析正确的是______(填序号)。
A.海水进入贮水池,氯化钠溶液的成分基本不变
B.在①的溶液中氯化钠的质量变大
C.结晶池中氯化钠溶液中的溶剂减少
D.析出晶体后的母液是食盐的不饱和溶液
E.海洋中蕴藏着丰富的资源
解析:由于海水晒盐是靠蒸发水分,故①是蒸发池;海水进入贮水池,各成分基本不变,但在蒸发池中,随着水分的不断蒸发,溶剂不断减少,但溶质氯化钠的质量不变,只是浓度变大;达到饱和后继续蒸发,溶液中会析出氯化钠晶体,将晶体分离出去后剩下的溶液称为母液,它仍然是氯化钠的饱和溶液,利用其可生产出多种化工产品,因此海洋中蕴藏着丰富的资源。故A、C、E正确。
答案 (1)蒸发 (2)ACE
2.用硝酸钾代替氯化钠做上面的实验。不过当有硝酸钾剩余时,不再加水,而是改为加热。
|
操作 |
现象 |
结论 |
|
加入5 g硝酸钾,搅拌 |
固体溶解 |
温度不同,物质的溶解能力不同。一般来说,温度越高,溶解能力越强 |
|
加入5 g硝酸钾,搅拌 |
固体剩余一部分 |
|
|
加热 |
剩余固体溶解 |
|
|
加入5 g硝酸钾,搅拌 |
固体溶解 |
|
|
冷却 |
有固体析出 |
(1)饱和溶液与不饱和溶液的概念
在一定温度下,一定量的溶剂里,不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液;还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液。
说明:①强调“一定温度”和“一定量溶剂”。因为改变溶剂量或温度,饱和溶液与不饱和溶液可以互相转化。如上面的探究中,氯化钠溶液中有固体剩余,说明溶液是饱和的。当加入水后,又继续溶解,说明又变为不饱和溶液。用硝酸钾进行实验时,加热时,原来未溶解的硝酸钾又继续溶解,说明温度升高,原来的饱和溶液又变为不饱和的了。
②指明“某一溶质”。例如,在一定条件下不能再溶解食盐的溶液,可能还能溶解蔗糖,此时的溶液对于食盐来说是饱和溶液,对蔗糖来说就不是饱和溶液。因此必须指明是哪种溶质的饱和溶液或不饱和溶液。
(2)判断溶液是否饱和的方法
①在一定温度下,观察该溶液中有没有不能继续溶解的剩余溶质存在,如有且溶质的量不再减少,那么这种溶液就是这种溶质的饱和溶液。
②在其他条件不变的情况下,向溶液中加入少量该溶液的溶质,搅拌,观察该溶液还能否再继续溶解所加溶质;若不能再溶解,溶质的量不再减少,那么这种溶液就是这种溶质的饱和溶液。
(3)饱和溶液与不饱和溶液的相互转化

说明:①此转化条件适合于大多数溶解能力随温度升高而增大的固体物质。如硝酸钾、氯化铵等。
②对于极少数溶解能力随温度升高而减小的物质不适合。例如熟石灰,若通过改变温度把熟石灰由不饱和溶液变为饱和溶液,应升高温度,而将其由饱和溶液转化为不饱和溶液,则需要降低温度。
状元笔记
使不饱和溶液变为饱和溶液最可靠的方法是增加溶质。如果通过改变温度的方法则需要根据该溶质的溶解能力与温度的关系来确定。
(4)浓、稀溶液与饱和溶液、不饱和溶液的关系
为了粗略地表示溶液中溶质含量的多少,常把溶液分为浓溶液和稀溶液。在一定量的溶液里,含溶质的量较多的是浓溶液,含溶质的量较少的是稀溶液。
对于含不同溶质的溶液,浓溶液不一定是饱和溶液,稀溶液也不一定是不饱和溶液,反之亦然。但对于同种溶质来说,在一定温度时,其饱和溶液一定比其不饱和溶液要浓。
[示例]下列有关饱和溶液和不饱和溶液的叙述中,正确的是( )
A.在一定量的溶剂里,不能再溶解溶质的溶液为该溶质的饱和溶液
B.在一定温度下,某物质的饱和溶液一定是浓溶液
C.在一定温度下,稀溶液一定是不饱和溶液
D.饱和溶液和不饱和溶液之间可以互相转化
解析:对于A,没有指明“一定温度”,该溶液就不一定是饱和溶液。饱和溶液不一定是浓溶液,如微溶于水的Ca(OH)2,在一定温度时,其饱和溶液是稀溶液,反之亦然,如一类溶解性很大的物质NaCl、KNO3等,其浓溶液也不一定是饱和溶液。
答案:D
状元笔记
溶液的浓、稀与一定量溶液里所含溶质的量有关;溶液的饱和、不饱和与一定条件下溶液里溶解物质的限度有关,最大限度为饱和溶液。这是从不同角度描述溶液性质的两个概念。
活动与探究:
1.在常温下,向装有20 mL水的烧杯中,不断加入氯化钠。
|
操作 |
加入5 g氯化钠,搅拌 |
再加入5 g氯化钠,搅拌 |
加入5 mL水,搅拌 |
|
现象 |
全部溶解 |
有一部分不能溶解 |
又溶解一部分 |
|
结论 |
一定量的水中,不能无限溶解某种物质 |
2.几种维生素的功能
|
重要维生素 |
食物来源 |
作用 |
缺乏症 |
|
维生素A |
蛋类、鱼卵、动物肝、鲜奶;胡萝卜、菠菜、青椒等内的胡萝卜素能转变为维生素A |
使人维持正常的视力 |
夜盲症等 |
|
维生素B |
豆荚、糙米、绿叶蔬菜、麦片、瘦肉、蛋类、动物心、肝、花生米、蛋黄等 |
在增进食欲、保护神经系统、促进消化吸收、乳汁分泌等方面都有十分重要的作用 |
缺乏维生素B易患脚气病 |
|
维生素C |
新鲜的蔬菜、水果,如柑橘、柠檬、葡萄、西红柿、胡萝卜等 |
参与氨基酸的代谢;增强毛细血管的管壁韧性和健全血管等 |
皮肤、黏膜出血;牙龈出血、牙龈炎等 |
|
维生素D |
各种鱼肝油、奶油、蛋黄、鱼和动物的肝脏 |
促进肠道对钙和无机磷的吸收,有助于骨骼和牙齿的发育 |
龋齿、骨质疏松、儿童佝偻病、成年人骨质软化、骨骼畸形、骨疼痛 |
[示例] 维生素对人体的作用是( )
①调节新陈代谢 ②供给能量 ③预防疾病 ④维持身体健康
A.①③④ B.①②③ C.②③④ D.①③
解析:维生素不能供给能量,它的主要作用是调节人体的生命活动。故①③④是正确的。
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com