
题目列表(包括答案和解析)
6、关于溶液的酸性、酸性强弱的说法中,正确的是( )
A.只要溶液中有H+,溶液就显酸性
B.H+浓度大于OH-浓度,溶液一定显酸性
C.H+ 浓度增大,溶液的酸性一定增强
D.强酸溶液的酸性一定比弱酸溶液的酸性强
5、常温下,测得柠檬水溶液的pH是3,其中的c(OH-)是( )mol/L:
A.1x10-3 B. 0.1 C.1x10-7 D.1x10-11
4、已知热化学方程式:SO2(g)+
O2(g) 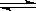 SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2 和1molO2充分反应,最终放出的热量为( )
SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2 和1molO2充分反应,最终放出的热量为( )
A. 196.64kJ B. 196.64kJ/mol C. <196.64kJ D. >196.64kJ
3、在pH =1的无色溶液中,能大量共存的是:( )
A. Al3+ 、Na+、NO3-、Cl- B. Cu2+ 、Na+、NO3-、Cl-
C. Ba2+、K+、CO32-、MnO4- D. NH4+ 、H+ 、CH3COO-、 OH-
1吸热反应一定是 ①释放能量 ②吸收能量 ③反应物的总能量低于生成物的总能量 ④生成物的总能量低于反应物的总能量( )
A.①③ B.②③ C.①④ D.②④
2、在2A+B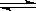 3C+4D反应中,表示该反应速率最快的是( )
3C+4D反应中,表示该反应速率最快的是( )
A.υ(A)= 0.5 mol/(L·s) B.υ(B)= 0.3 mol/(L·s)
C.υ(C)= 0.8 mol/(L·s) D.υ(D)= 1 mol/(L·s)
30. 含有SiO2杂质的赤铁矿粉(成份Fe2O3)10克,与50ml H2SO4溶液充分反应,再加入5.04克铁粉,这时能产生H2 448ml(标况下),反应后剩余铁粉1.12克,计算:
(1)赤铁矿中铁元素的质量百分含量
(2)求H2SO4的物质的量浓度
29. 向100mL 1mol/L的KAl(SO4)2溶液中,逐滴滴加1mol/L的Ba(OH)2溶液至过量。问:
(1)在滴加Ba(OH)2溶液的过程中,首先 离子完全沉淀(填离子符号)。此时另外一种沉淀的物质的量为 ;
(2)当加入的Ba(OH)2为 mL时,沉淀的量不再发生改变,此时溶液当中的含有的溶质为 ;
(3)若将相同的Ba(OH)2的溶液逐滴滴加至100mL 1mol/L的Al2(SO4)3溶液中,当加入的Ba(OH)2为 mL时,沉淀的量不再发生改变。此时,沉淀的物质的量为 mol。
28. 海水中含有丰富的化学元素,下面是某化工厂从海水中提取NaCl、Mg(以MgCl2形式存在)的生产流程简图:

请回答:
(1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所需用的试剂除了氯化钡溶液 、氢氧化钠溶液 ,还需要 和 (填试剂名称)。
(2)目前工业上主要采用离子交换膜法电解饱和食盐水,将电解后所得Cl2和H2按1:a体积比,按图示流程合成质量分数为36.5%的盐酸。
 设每台电解槽平均每天消耗2.3×104mol食盐,电解生成的氯气与氢气按体积比1:1.15
设每台电解槽平均每天消耗2.3×104mol食盐,电解生成的氯气与氢气按体积比1:1.15
通入合成炉,不考虑各阶段的物料损耗,理论上可生产36.5%的盐酸 t。
(3)从MgCl2溶液得到MgCl2.6H2O晶体的过程中所需的基本操作依次有________
(A) 加热蒸馏 (B) 加热浓缩 (C) 冷却结晶
(D) 趁热过滤 (E) 过滤洗涤
(4)利用MgCl2·6H2O可制得无水氯化镁,应采取的措施是
(5)四川大地震后,为了抑制灾区疫情的发生和蔓延,需要大量消毒剂。而该化工厂生产的 和 (填化学式)是生产消毒剂的重要原料。
27. 某化学兴趣小组按照下列方案进行“由含镁废铝制备硫酸铝晶体”的实验:
步骤1:取一定量含镁废铝,加足量的NaOH溶液,反应完全后过滤。
步骤2:边搅拌边向滤液中滴加稀硫酸,并用玻棒与试纸不时地测溶液的pH至8-9,静置、过滤、洗涤。
步骤3:将步骤2中得到的固体溶于足量的稀硫酸。
步骤4:将得到的溶液蒸发浓缩、冷却、结晶、过滤、干燥。
请回答以下问题:
⑴ 上述实验中的过滤操作需要____________、_____________、___________等玻璃仪器。
⑵ 步骤1过滤的目的是__________________________________________。
⑶ 当步骤2中的溶液pH为8-9时,检验沉淀是否完全的方法是___________________。
⑷ 步骤2中溶液的pH控制较难操作,可改用加入
A. NaOH溶液 B. 氨水 C. Al2O3 D. Na2CO3
26.某河道两旁有甲、乙两厂。他们排放的工业废水中,共含K+、Ag+、Fe3+、Cl-、OH-、NO3-六种离子。
(1)甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是 、 、 ;
(2)乙厂的废水中含有另外三种离子。如果加一定量的 (选填“活性炭”、“硫酸亚铁”、“铁粉”),可以回收其中的金属 (填写金属元素符号)。
(3)另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的 和 ,以及 和 (填写离子符号)相互结合转化为沉淀。经过滤后的废水主要含 ,可用来浇灌农田。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com