
题目列表(包括答案和解析)
4.
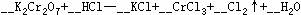
3.
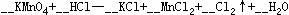
2.
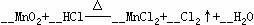
1.

②pD=-lg[D+]=-lg16×10-14≈12.8;③pD=-lg[D+]=-lg0.01=2; ④[D+]=0.1(mol.L-1);pD=-lg[D+]=-lg0.1=1. 27. 解:根据有关化学方程式得: IO3- ~ 6S2O32- n(IO3-)=0.03mol/L×18×10-3L÷6=9×10-5mol m( KIO3)= 9×10-5mol×214g/mol=19.26mg 每千克食盐含KIO319.26mg÷0.428=45mg>40 mg) 该食盐合格
24. ①A B ②[K+]≥0.2mol.L-1 [SO42-]=0.1mol.L-1 [CO32-]=0.2mol. .L-1 [NH4+]=0.4mol.L-1 25. (c)(j)(k)(m)
23.(1) K2CO3 当CO32-水解到一定程度时KOH又与KHCO3反应最后得到K2CO3。
(2)(NH4)2SO4溶液中虽然NH4+水解生成NH3·H2O,但由于生成的H2SO4为不挥发性强酸,随H2SO4浓度增大,将再与NH3·H2O反应生成(NH4)2SO4。
(3)BaCO3由于在溶液中Ba(HCO3)2是分解生成BaCO3和CO2、H2O ,随着浓缩的不断进行,CO2不断逸出,最后剩余BaCO3。
(4)Na2SO4 由于蒸发过程中Na2SO3不断被氧化,最终生成Na2SO4 。
(5)Mg(OH)2由于Mg(HCO3)2分解生成MgCO3,进而转化成更难溶的Mg(OH)2。
22.(1) 100mL容量瓶(注:未标明规格的扣1分)(2分) (2)>b(多选扣分)(各2分,共4分) (3)配制pH=l的HA溶液难以实现 不妥之处在于加入的锌粒难以做到表面积相同(各2分,共4分) (4)配制NaA溶液,测其pH值>7即证明HA是弱电解质(2分) (注:本题解答若操作简单、现象 明显)
27、(8分) 为了预防碘缺乏病,国家规定每千克食盐中应含有40-50毫克的碘酸钾。为检验某种食盐是否为加碘的合格食盐,某同学取食盐样品428克,设法溶解出其中全部的碘酸钾。将溶液酸化并加入足量的碘化钾淀粉溶液,溶液呈蓝色,再用0.030 mo1·L-1的硫代硫酸钠溶液滴定,用去18.00mL时蓝色刚好褪去。试通过计算说明该加碘食盐是否为合格产品。有关反应如下: IO3-+5I-+6 H+→3I2+3H2O I2+2S2O32-→2I-+S4O62- 答案
第3章 物质在水溶液中的行为
本章测试题
25、(4分) 某学生中和滴定实验的过程如下:(a)取一支碱式滴定管,(b)用蒸馏水洗净,(c) 即加入待测的NaOH溶液,(d)记录液面刻度读数,(e)用酸式滴定管精确放出一定量标准酸液,(f)置于未经标准酸液润洗的洁净的锥形瓶中,(g)加入适量蒸馏水,(h)加入酚酞试液两滴,(i)滴定时,边滴边摇荡,(j)边注视滴定管内液面的变化,(k)当小心滴到溶液由无色变成粉红色时即停止滴定,(l)记录液面刻度读数,(m)根据滴定管的两次读数得出NaOH溶液体积为22毫升.指出上述实验过程中错误之处(用编号表示)_____________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com